- 現在位置
- トップ > 政策・審議会 > 審議会情報 > 科学技術・学術審議会 > 資源調査分科会 > 光資源を活用し、創造する科学技術の振興-持続可能な「光の世紀」に向けて- > 第3章 健康なくらしに寄与する光 3 光を用いた非侵襲生体診断
第3章 健康なくらしに寄与する光 3 光を用いた非侵襲生体診断
電気通信大学電気通信学部教授 山田幸生
3-1 生体医用光学
生体医用工学の一分野として生体医用光学があり、生体内の光伝播現象の解明とその応用としての医用光学が研究開発されている。医用光学は、大きく光を用いた治療と生体診断に分けられる。本報告では光を用いた非侵襲生体診断について現状と将来について記述する。
まず、光が生体内を伝播する現象の物理を簡単に説明し、生体における光学的窓と呼ばれる近赤外光を用いた非侵襲生体診断に関する各種の技術について述べ、最後に今後の動向を記す。
3-2 生体組織の光学的窓
光は波動性(光の干渉や偏光などの性質)を持ち、その伝播に伴いエネルギーが輸送される。光が生体組織中を伝播する際には、光は生体組織により強く散乱される。生体組織に照射した光がはじめに持っている波動性は、散乱を繰り返すごとに急速に失われ、生体組織内を数mmも進めば光の波動性はほとんど無視することができる。その結果、生体内の光伝播に伴って単にエネルギーが輸送されていると考えることができる。そのような状況では、生体組織と光の相互作用は図1にように光の散乱と吸収によって記述することができる。従って、生体内の光伝播現象の理解には、生体組織の散乱と吸収に関する光学特性値の波長依存性、つまり、スペクトルが重要な要素となる。
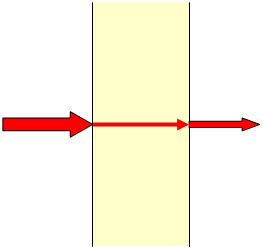
(a)
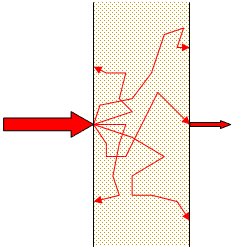
(b)
図1 生体組織による光の(a)吸収と(b)散乱
波長200νμら10μμでの光に対して、生体内に存在する主な光吸収物質は、水と血液中に存在する酸素輸送媒体のヘモグロビンであり、それらの吸収スペクトルは図2のように波長に強く依存する(注1)。ヘモグロビンは700νμ謔閧熹g長が短い可視光に対して強い吸収を持ち、水は2μμよりも波長が長い中赤外光および遠赤外光に対して強い吸収を持つ。波長がおよそ700νμから2μμまでの近赤外光に対してはヘモグロビンと水の吸収が弱いために近赤外光は生体組織に深く浸透する。このため、光を用いた生体診断には近赤外光が用いられることが多く、この波長域は生体の光学的窓とも呼ばれる。各種レーザー光の生体組織への浸透深さはおよそ図3のようになる。
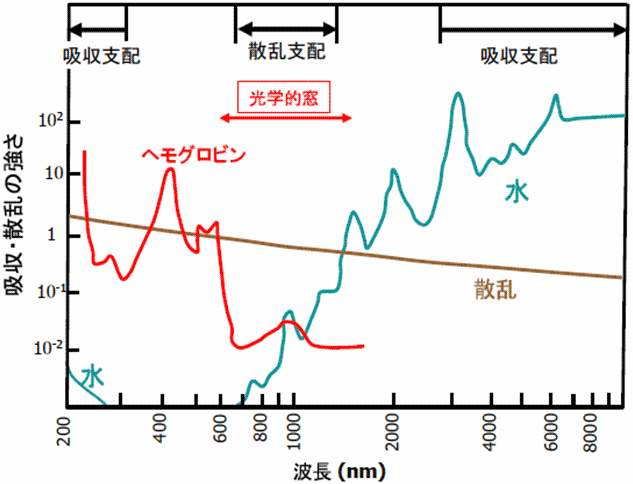
図2 生体組織による光吸収・散乱の波長特性
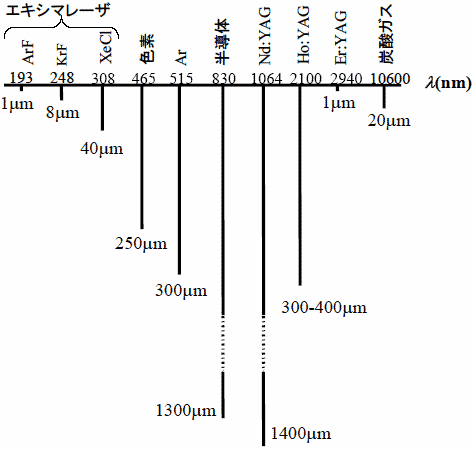
図3 各種レーザ光の生体組織への浸透深さ
一方、生体組織が光を散乱する強さは図2に示されるように波長が長くなるにつれて徐々に弱くなる。ヘモグロビンと水の吸収が強い波長では散乱よりも吸収が強い場合が多いが、近赤外光では吸収よりも散乱がずっと強い。散乱する媒体内の光伝播挙動は複雑なため、これまで定量的な扱いが難しかった。しかし、1990年代になり、散乱媒体中の光伝播挙動の理解が進み、計算機によるシミュレーションが可能となると共に、生体診断に近赤外光を用いる研究が行われ、かつ、新しい技術が開発されるようになった。
近赤外光を用いた生体診断として最も広く利用されている手法は血液あるいは生体組織中血液の酸素化度測定である。これは、図4に示されるヘモグロビンの酸素化および脱酸素化に伴う吸収スペクトルの変化、言い換えれば色の変化を検出し、ヘモグロビンの酸素飽和度および血液量の変化を測定する技術である。しかし、前述したように近赤外光に対する生体組織の散乱は吸収よりも10倍以上強いため、散乱によって歪められた光信号から微小な吸収の情報を引き出さねばならないため、各種の工夫が必要となる。
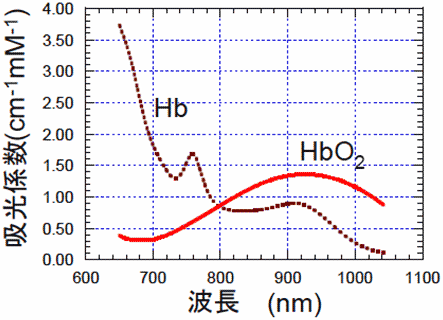
図4 酸素化ヘモグロビン(Hb)と脱酸素化ヘモグロビン(HbO2)の吸収スペクトル
近赤外光を用いる代表的な生体診断技術は次の7種類が挙げられる。
- パルスオキシメータ
- OCT(Optical Coherence Tomography:光干渉断層画像)
- 酸素モニター
- 光マッピング(Optical Mapping、or Optical Topography)
- 拡散光トモグラフィー(DOT:Diffuse Optical Tomography)
- 小動物の蛍光および生物発光イメージング
- 非侵襲血糖値測定
これらの診断技術について以下に記述する。
3-3 パルスオキシメータ
パルスオキシメータは、動脈血の酸素飽和度と脈拍を極めて簡便に測定する装置である。1974年に青柳卓雄氏により開発されたパルスオキシメータの原理(注2)は図5に示されている。指や耳たぶなど、10mm程度の厚さの組織に近赤外光を照射し、組織内を散乱透過した光を検出すると、光の減衰(吸光度A=-log(I/I0):I0、Iは入射光および検出光強度)は脈拍に応じて変動する。減衰の変動成分は、組織内の動脈が心拍に伴って拡張と収縮を繰り返すために生じる。従って、変動成分は動脈血の情報を与える。入射光として近赤外光の2波長を用いると、図2のグラフから動脈血の酸素飽和度を知ることができる。パルスオキシメータは世界中で非常に広範に使用されており、日本発の誇るべき技術である。
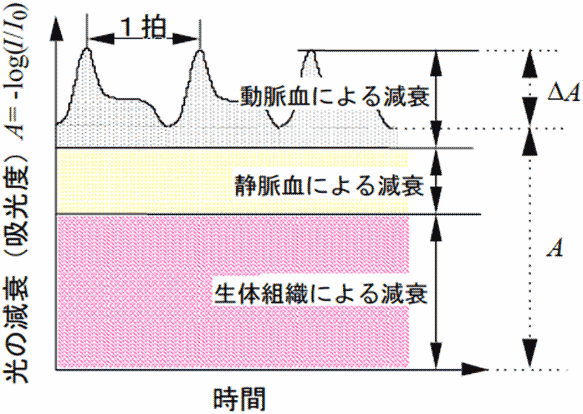
図5 パルスオキシメータの原理図
3-4 OCT(Optical Coherence Tomography:光干渉断層画像)
この技術は、上記6種の技術のうち光の波動性を利用する唯一の技術であり、1990年代初頭に日本と米国でほとんど同時に開発された(注3)(注4)(注5)。原理図は図6に示されている。1,300nm程度の低干渉性の光が発光ダイオードより出され、光ファイバーに導かれる。光は干渉計で2分岐され、一方の測定光は観察対象である生体組織へ、一方は参照光としてミラーに導かれる。測定光は生体に照射されるとその一部が後方に散乱されて再び光ファイバーに入る。参照光もミラーで反射されて光ファイバーに戻る。戻ってきた測定光と参照光は再び干渉計に入り、両者の光路長差が半波長の整数倍かそうでないかによって干渉計を通った光が強まったり弱まったりする。従って、参照光ミラーを光軸に沿って波長オーダーの長さで精密に移動させることにより、生体組織から後方散乱によって戻ってきた光強度の深さ方向分布を知ることができる。測定光を組織の表面に沿って移動させながら参照光ミラーを光軸に沿って移動させれば、組織から後方散乱により戻って来た光強度の2次元分布いわゆる断層画像を得ることができる。組織により後方散乱された後の光が干渉性を維持していなければならないため散乱回数が少ない浅い部分のみが対象となる。実際には、深さ1mm程度が限界である。
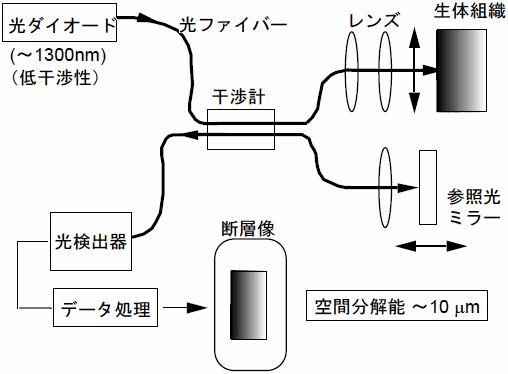
図6 OCT(Optical Coherence Tomography:光干渉断層画像)の原理図
このようにして得られた網膜の断層画像の例が図7であり、網膜を構成する複数の薄い層が明瞭に分離して観察されている。空間分解能は数μμ程度である。図7では、網膜の中心部に存在する視力の最も良い場所である黄斑部に孔が開く病気によって生じた病変部(黄斑円孔)の断層像を描き出した画像である。網膜の厚さは200~300μμであるが、黄斑部は窪んでおり、50μμ程度の厚さである。病変部以外にも、網膜を形成する多くの層が見分けられ、網膜の外側にある脈絡膜や、網膜と脈絡膜の境界にある網膜色素上皮が明瞭に観察されている。以前は、このような断層画像は摘出した眼球組織から網膜部分を切り出して染色して顕微鏡で観察するしかなかったが、in vivo(生きた状態)で観察可能となったことは画期的であり、現在では眼科領域で広く使われている。この技術は近年、高速化、高空間分解能化などを目指した数多くの研究開発が行われると共に、内視鏡への応用など各種医療分野への展開が期待されている。
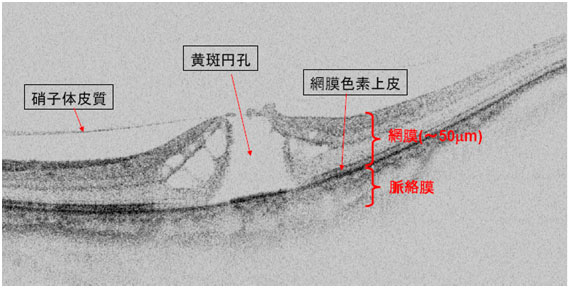
図7 網膜の黄斑部に発生した黄斑円孔のOCT画像(筑波大学 谷田貝研究室 提供)
3-5 酸素モニター
酸素モニターは、パルスオキシメータとは異なり、動脈血ではなく、生体組織の平均的な酸素化度と血液量の変化を示す。2ないし3波長の近赤外光を皮膚に照射し、生体組織内で散乱反射して皮膚表面に戻ってきた光を検出し、ヘモグロビンによる吸収と組織による散乱を考慮した計算式を用いて、酸素化ヘモグロビン(HbO2)と脱酸素化ヘモグロビン(Hb)の濃度変化と、その合計であるヘモグロビン総量(血液量に比例)の変化を求めることができる。しかし、これらの絶対値を求めるには、光が進んできた平均の行路長(平均光路長)を必要とするが、それを測定することは困難であるため、得られた数値は測定開始時からの相対的な変化量である。従って、特定の被験者の特定部位における時間的な変化を知ることはできるが、別な被験者や同じ被験者でも異なる部位における測定結果を比較して論じることは適当ではない。
それにもかかわらず、この測定法は組織の酸素化度や血液量の変動を簡便に計測できるため、各種の情報を得ることができる(注6)。例えば、被験者の前頭部に酸素モニターを装着し、記憶を必要とする課題を与えると、図8のように脳の前頭前野の活動をモニターすることができる。図8は、いわゆるworking memory task(一時記憶保存タスク)として、男子大学院生にn-back taskを課したときの結果である。n-back taskには各種の方式があるが、図8の場合は、画面に1から4までの数字のどれか一つが1。8秒ごとに合計40個現れ、1 back taskは一つ前に見た数字を、2 back taskは二つ前に見た数字を答えるタスクである。そのような課題を遂行している間に計測された脱酸素化ヘモグロビン濃度変化、Δ[Ηβ]、酸素化ヘモグロビン濃度変化、Δ[ΗβΟ2]および総ヘモグロビン濃度変化、Δ[τοταλ-Ηβ]の時間経過を表している。1 back task時には脳の活性化が認められず、2 back task時にはプローブが装着された背外側前頭前野で血液状態が変化し、脳が活性化した様子を知ることができた。しかし、これはある特定の被験者の結果であり、これが一般的であるとはかならずしも言えない。特に、この酸素モニターは1対の照射・検出プローブを用いており、前頭部の特定の領域のみの結果である。また、検出された近赤外光が脳のどの深さまで到達したかを知ることは困難であるが、光伝播シミュレーションなどの結果から皮膚表面からおよそ20mmの深さまでは到達していると考えられている。
酸素モニターでは平均光路長を計測できないことが課題であると述べたが、平均光路長を測定するために時間分解計測法を採用した機器も開発されている。
近赤外光を用いた酸素モニターは、上記のような脳の高次機能の計測のみでなく、各種の刺激に対する脳活動の反応や、運動による筋肉組織中の血液状態の変動計測にも用いることができるため、臨床応用が広がっている。
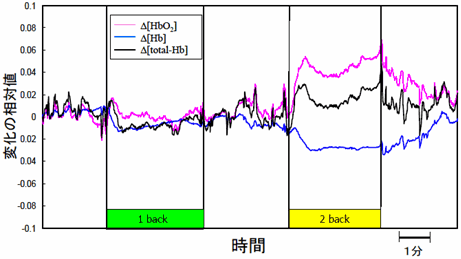
図8 酸素モニターによる前頭前野におけるworking memory task(一時記憶保存タスク)遂行時の血液状態変動の計測結果(東京都精神医学総合研究所 星 詳子氏 提供)
3-6 光マッピング(Optical Mapping、or Optical Topography)
光マッピング(あるいは光トポグラフィー)は、図9に示すように複数の酸素モニターを同時に用いることにより、血液状態の変化を生体表面に沿って2次元画像として描き出す技術(注7)である。特に、ヒト頭部に多くのプローブを装着し、各種の刺激に対して脳がどのように活動するかを画像として見ることができるため、高次脳機能の研究や医学的応用が急速に広がっている。脳の高次機能を調べる装置として、fMRI(functional Magnetic Resonance Imaging:機能的磁気共鳴イメージング)やPET(Positron Emission Tomography:陽電子放出トモグラフィー)、MEG(Magnetoencephalography:脳磁図)、脳波イメージングがあるが、前3者は、脳の深部における活動も調べることが可能であるが、大きな装置を用い、被験者の動きを拘束した状態で計測する必要があり、被験者の自由な姿勢や運動は不可能である。脳波イメージングは、簡便ではあるが、電気的な雑音に弱く、信号の起源も明確でないため得られた画像の信頼性が低い。
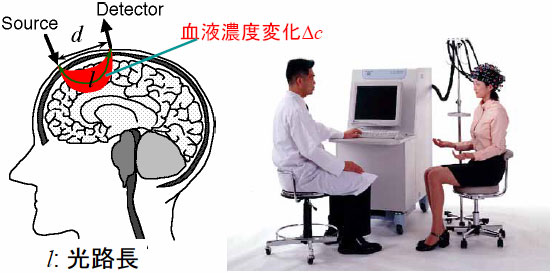
図9 光マッピング(光トポグラフィー)の原理図と実験風景(日立製作所 提供)
光マッピングは、酸素モニターと同様に、脳の表層部の情報しか得られないが、装置が簡便であること、被験者が比較的自由な姿勢や動きが可能なことから、他の装置では行うことができない状況での脳活動を画像化することができるという利点を有する。そのため、現在、高次脳機能の研究のみでなく、リハビリの効果の確認や、各種刺激に対する脳活動の反応の研究、機械を脳における思考で動かす装置のインターフェイス(Brain Machine Interface)など、非常に幅広い分野で応用されつつある。
光ファイバープローブは、30mm間隔でほぼ正方形の領域に4個の入射用プローブと4個の検出用プローブが交互に配置されており、800nm前後の2波長を用いて計測を行う。検出された光のデータを30mm離れた入射点と検出点の中点(合計24点)に置き、24個のデータを単純につなぐという簡単なアルゴリズムで次元画像が得られる。1枚の画像を得るのに必要な計測時間は0。1s程度であるため、時間応答が速く、脳活動の変化をリアルタイムで追うことができる。図10は、被験者に右手を運動させたときに、左の運動野が活動したことを示す光マッピングの画像を被験者の外形と脳のMRI画像に重ね合わせて表示したものである。
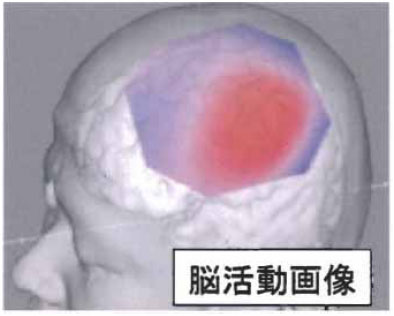
図10 光マッピング(光トポグラフィー)による運動野の脳活動画像の例(日立製作所 提供)
光マッピング画像の空間分解能は低く、良くても10mm程度であると考えられる。酸素モニターと同様な短所を持ち、脳の深部の情報は得ることができず、また、絶対値表示ができないため個人間の比較はできない。それにもかかわらず、簡便さのために前述したような多くの分野で応用され始めている。この技術も日本から発信した生体医用光学分野の新技術である。
3-7 拡散光トモグラフィー
拡散光トモグラフィーは、酸素モニターや光マッピングの短所である絶対値表示ができないという課題を解決し、近赤外光を用いて生体組織の断層画像を得る技術である。この技術における画像の構築(画像再構成)では、意味のある多くの測定データを収集することと、測定データから画像を再構成するアルゴリズムの開発が重要なテーマである。全体の概要は図11のように表され、データ計測部と画像再構成アルゴリズムに分けられる。
データ計測部では、対象とする生体表面のある1点に近赤外光を入射し、生体内で散乱・吸収を受けながら伝播して再度生体表面に現れた光を多くの点で同時に検出する。入射点を変えながら同様の計測を行い、多くのデータを収集する。この際、用いる光源は連続光でも良いが、データの数は限られてしまう。独立なデータの数を増やすため、ピコ秒のパルス光源とピコ秒の時間分解能を持つ検出計を有するピコ秒時間分解計測システムを用いるのが良いことが分かっている。
画像再構成アルゴリズムにおいては、生体の光学特性値(吸収係数と散乱係数)分布を仮定して生体内の光伝播モデルを数値的に解く(順問題)。その結果を計測データと比較して一致すれば仮定した光学特性値分布が正しいとして画像が再構成されたと考える。一致しなければ光学特性値分布を仮定しなおして再び順問題を解き、一致するまでこの操作を繰り返す(逆問題)。このアルゴリズムでは生体内の光伝播モデルが決定的に重要な役割を果たし、光拡散方程式が用いられることが多い。
得られた光学特性値分布を表す画像は、図4のヘモグロビンの吸収スペクトルを用いて血液状態の画像に変換される。
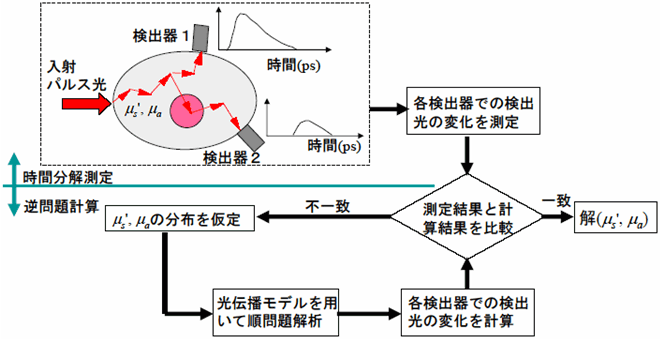
図11 拡散光トモグラフィー(DOT)のアルゴリズム概念図
図12は成人の手首に16本の光ファイバープローブを装着し、手のグリップ運動による血液状態の変化を画像化したときの様子である。測定方式は時間分解計測法を用い、得られた時間分解データは、ラプラス変換を利用する一般化パルススペクトル法を用いたアルゴリズムに入力され、画像が再構成された。


図12 前腕の運動負荷による筋肉活動に関する拡散光トモグラフィーの実験風景
図13は得られた血液状態の画像(注8)であり、それぞれ脱酸素化ヘモグロビン、酸素化ヘモグロビン、および総ヘモグロビンの運動前後の変化量([ΔHb]、[ΔHbO2]、[ΔHb]+[ΔHbO2])の分布が数mmの空間分解能で示されている。数値は酸素モニターや光マッピングのように相対的なものではなく、絶対値で表されている。これらの数値が正か負かによって、筋肉の部分や太い動脈の位置が特定され、それらの血液状態の変化が定量的に得られている。
図12のように対象を透過した光が検出できる場合(透過型)には、このような品質の高い拡散光トモグラフィー画像を得ることができるが、直径10cmの大きさが限度である。低体重出生児の頭部などは透過型が適用できるが、成人頭部に対して透過型は不可能であり、光マッピングのように拡散反射光を検出する反射型を採用せざるを得ない。しかし、反射型では、深部の情報が欠けるため、画像再構成にはさらなる工夫が必要である。
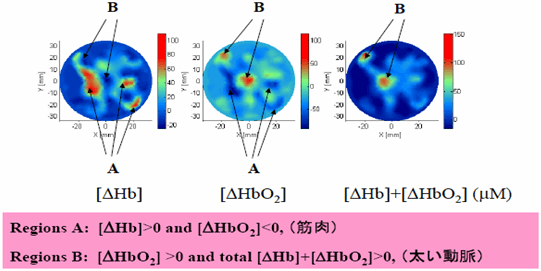
図13 前腕の運動負荷による血液状態変化に関する拡散光トモグラフィー画像
精密な頭部形状の測定と適切な光伝播モデルの採用により、ドライビングシミュレータを操作したときの前頭部の脳内血液状態変化を反射型拡散光トモグラフィーにより画像化(注9)した結果が図14である。頭部の形状画像と脳のMRI画像に拡散光トモグラフィー画像を重ね合わせてあり、脳活動の位置が断層像として明瞭に示されている。
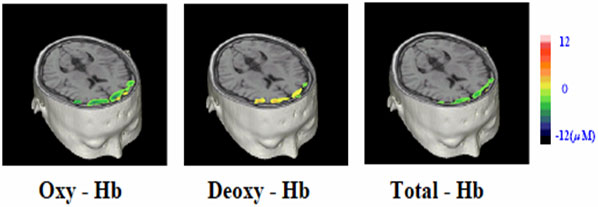
図14 反射型拡散光トモグラフィーによるビデオゲーム時の前頭前野の脳活動に伴う血液状態の変化(浜松ホトニクス 提供)
ピコ秒時間分解計測システムは質の高い拡散光トモグラフィーの画像を得るのに極めて有効であることが示されたが、このシステムは現状の技術では極めて高価である。もっと安価な時間分解計測システムも開発されつつあり、今後、時間分解計測法を用いた拡散光トモグラフィーの技術が進展することが期待される。
3-8 小動物の蛍光および生物発光イメージング
これまでに述べた光による生体イメージングは、生体に内在する色素であるヘモグロビンの酸素状態による光学特性値の変化を画像化するものである。しかし、内在する色素の光学特性値の時間的変動や空間的分布の変化は小さいため、得られた画像の品質はそれほど良くない。また、内在する色素の分布のみから、各種の生理学的・病理学的情報は得られない場合が多い。
そこで蛍光や生物発光などを発し、かつ特定の生理学的・病理学的情報を与える物質を生体内に導入し、体表面で蛍光や発光を観測して内部の蛍光や発光物質の濃度分布や蛍光寿命などの特性を画像として求め、それらの画像から生理学的・病理学的情報を得ようとする技術が研究開発されている。
このような技術は、特に新薬開発や遺伝子発現研究などにおいて、小動物を用いた実験に利用することが容易であるため、分子イメージング(注10)の光を用いた手法として最近急速に注目され発展している。なお、「分子イメージング(Molecular Imaging)」とは「生きた組織における細胞レベルでの生物学的プロセスの視覚的な表示・特性記述・定量化」と定義され、PET、fMRI、マイクロx線CT、超音波、光など、各種の手法がそれぞれ相補的に利用され、研究開発が行われている。ヒトへの応用は、乳房を対象とする場合や内視鏡を用いた手法以外は、体内に導入する薬剤の毒性の問題や、対象のサイズが大きいため体内深部からの蛍光や発光の検出の困難性からまだ解決すべき課題が多く、将来のテーマと考えられている。
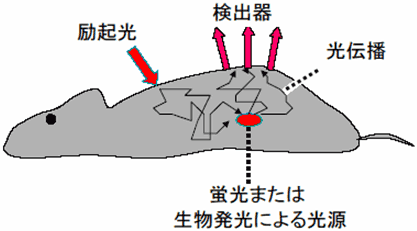
小動物を対象とした蛍光イメージング・生物発光イメージングは、概念図としては図15のように表される。蛍光イメージングでは、動物にあらかじめ蛍光特性を持つ薬剤を注入し、その後、蛍光を励起する励起光を照射して蛍光を発生させる。その蛍光を体表面で検出して画像化する。生物発光イメージングでは、生体内の特定の物質と結合することによって発光する特性を持つ薬剤を動物に注入し、その後、自ら発光したところでその生物発光を体表面で検出して画像化する。
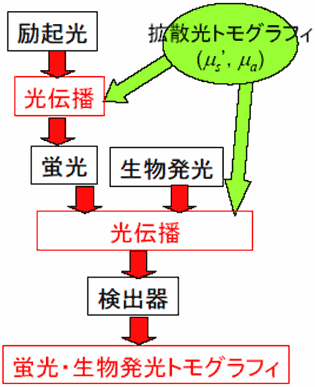
蛍光および生物発光イメージングはその画像化の手法から大きく2つに分類される。一つは、体表面で検出された蛍光や発光強度を体表面に沿って画像化するいわゆる蛍光マッピングあるいは生物発光マッピングであり、もう一つは体表面で検出された蛍光や生物発光のデータからそれらの特性を断層像として描き出すいわゆる蛍光トモグラフィーあるいは生物発光トモグラフィーの技術である。これらは、それぞれ光マッピングおよび拡散光トモグラフィーに対応すると考えて良い。
(a)
(b)
図15 小動物の蛍光または生物発光トモグラフィの(a)概念図および(b)プロセス
生物発光マッピングの装置は簡単なものであり、暗箱に試料台と高感度のCCDカメラがあって、試料台に生物発光する薬剤を投与し、麻酔した小動物を載せて撮影するだけである。ヌードマウスなどを使い、ホタルの発光基質Luciferinと発光酵素Luciferaseが体内で反応するように処理を行い、生じた生物発光(波長はおよそ480nm)を生体表面で観察し、そのマッピング画像を事前に撮影した白色光による写真に重ね合わせるという単純な操作で画像が得られる(注11)。
しかし、生物発光マッピングにおいては発光源の深さを特定することが困難であり、そのため、発光の強さを定量的に示すことは困難となる。蛍光マッピングも同様に比較的容易に画像が得られるが、定量性に問題がある。定量性を確保するためには発光源の空間的位置と光源強度を断層像として描き出す生物発光・蛍光トモグラフィー技術を必要とする。これらのトモグラフィーは、前節の拡散光トモグラフィー技術の応用として実現が可能であり、近年、その研究の進展には著しいものがある(注12)(注13)(注14)。
3-9 非侵襲血糖値測定
糖尿病患者の急速な増加に伴い、血糖値測定の重要性が増している。現在、血糖値は、指先などから微量の血液を採取して、電気化学的な手法で測定されているが、血液採取の侵襲性および1日数回が限度という課題があり、非侵襲で頻繁な測定が可能な血糖値測定技術が望まれている。その有望な手法として各種の光を用いる手法が研究され、これまで多くの研究機関や企業等で開発競争が行われてきたが、いまだに実用化された技術はない。血糖値つまり、血液中のグルコース濃度は正常時でもおよそ100mg/dlという微量であるため、光による非侵襲血糖値測定は分光分析を用いた微量分析の手法を採用するのが普通である。
分光分析による微量分析では、通常、事前実験を行い、被験者(あるいは患者)のある時点における血糖値とその時の光スペクトル(皮膚に照射した光の反射光あるいは透過光スペクトル)を同時に測定することを繰り返し、多くのデータを取得して血糖値と光スペクトルとの関係を検量モデル(校正曲線)として作成する。その後、光スペクトルを測定して、それを検量モデルに入力して血糖値を得る。しかし、グルコースの近赤外光吸収スペクトルは波長が1,500nm付近にブロードで弱いピークがあるのみであり、グルコース濃度の変動による光スペクトルの変化は非常に小さい。しかも、グルコースのみでなく、たんぱく質、脂肪、尿素、水分、温度など他の生体成分濃度などが微量に変動しても、光スペクトルが変化する(注15)。従って、事前実験によって測定した光スペクトルには、グルコース以外の生体成分、いわゆる外乱要因の変動も含まれているが、それらの変動は簡便に測定することが困難であるため不明である。その結果、事前実験により作成された検量モデルは外乱要因の変動に極めて弱く、外乱要因の変動をグルコースの変動と捉えてしまう。結局、被験者や患者に大きな負担を強いる事前実験により作成された検量モデルに、事前実験で測定した光スペクトル以外の光スペクトルを代入すると全くおかしなグルコース濃度が算出されてしまう。これが、長い間、光を用いた非侵襲血糖値測定がうまく行かなかった理由である。
最近、この問題を解決するために、皮膚内の光伝播シミュレーションを用いて検量モデルを作成する手法(注16)が研究開発された。皮膚内の光伝播は皮膚の光学特性値(吸収と散乱の特性値)によって支配され、皮膚中のグルコース、たんぱく質、脂肪、水分量、温度などの各要因の変動によりそれらの光学特性値がどのように変化するかを定量的に決定することができる。従って、各要因が独立に変動したときの光スペクトル(波長がおよそ1,300nmから1,800nmまでの範囲)の変化をシミュレーションで予測することができる。その結果、グルコース濃度を含めて6個の要因が適当な範囲の上下限で変動したとすれば、2の6乗=64個のスペクトルが得られる。この64個のスペクトルとその時のグルコース濃度とのデータから、検量モデルを作成することができる。実際には、光スペクトルに個人差があるため、測定開始時に光スペクトルを測定し、それとシミュレーションによるスペクトル変動を足し合わせた64個の光スペクトルを合成し、それらを用いて検量モデルを作成する。
図16は健常な被験者に糖負荷試験を行ったときの本手法による血糖値推定結果と、採血による測定結果とを比較したものであり、本手法による結果が良好であることが分かる。この手法によれば、患者に多大な負担を強いる事前実験を行わなくとも検量モデルを作成することができるため、救急治療室(ICU:Intensive Care Unit)に運び込まれた患者でも血糖値を非侵襲で連続的に測定が可能となる。実際、ICUの患者で臨床試験を実施しており、良好な結果が得られている(注17)。しかし、かならずしも100パーセント良好な結果が得られるわけではなく、また、装置も大きいため、実用化に向けて改良を進める必要があるが、本手法は光による非侵襲血糖値測定の分野に大きなブレークスルーをもたらした。本手法の原理を用い、装置の小型化、さらなる汎用性の追求、シミュレーション技術の高度化、などにより、光を用いた非侵襲血糖値測定技術が臨床応用される日も近いと考えられる。
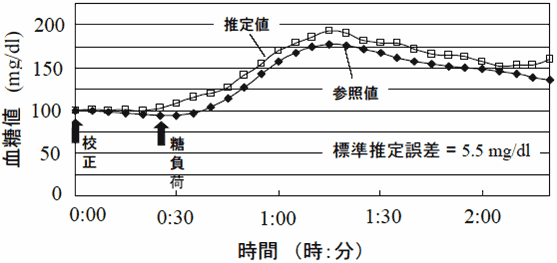
図16 シミュレーションにより作成した検量モデルから推定した血糖値と採血による参照血糖値との比較(被験者:45歳健常な男性)(松下電工 提供)
3-10 まとめと今後の生体医用光学
光、特に近赤外光を用いた生体診断技術について、特に上記7件の技術の現状を概観した。これらの技術はそれぞれ着実に進展しているが、特に今後大きく発展が予想される分野は、いわゆる分子イメージングに関連する技術であろう。OCT、光マッピング、拡散光トモグラフィー、蛍光・生物発光トモグラフィー、生体中微量成分の非侵襲測定は、それぞれの技術が個別に発展すると共に、分子イメージングに関連しながら融合的に進展していくと考えられる。また、ここでは取り上げなかったが、我が国が世界に先駆けて開発し、世界の市場の大きな割合を占めている内視鏡技術は我が国の誇るべき技術である。この技術は、従来の白色光による観察にとどまらず、蛍光を応用した新しい診断技術に発展し、今後の進展も期待される。さらに、生体医用光学の重要な分野として光を用いた治療技術が挙げられる。治療技術としては、単純に光のエネルギーを利用するレーザメスや組織凝固のような利用法から、光と反応して活性酸素を作り出す化学物質を導入して腫瘍を治療する光化学(光線力学的)治療(PDT:Photodynamic Therapy)、レーザー誘起応力波を用いた遺伝子導入技術、その他の技術が研究開発されつつある。
医用生体光学の分野は、日本では日本光学会の中に生体医用光学研究会が設立されて毎年活発な活動を行っており、世界的にも米国光学会(Optical Society of America)と米国光工学会(SPIE)が主導して毎年国際会議を開催しているが年々盛大になっている。また、世界の医学研究の中心である米国の国立衛生研究所(NIH:National Institute of Health)でも、定期的に生体医用光学の会議を開催し、今後、この分野が大きく発展すると予想されている。
参考文献
(注1)M. S. Patterson, et al., "The Propagation of Optical Radiation in Tissue. 2 : Optical Properties of Tissues and Resulting Fluence Distributions," Lasers in Medical Science, Vol.6, pp. 379-390 (1991).
(注2)青柳卓雄、他、「イヤピース・オキシメータの改良」、第13回日本ME学会大会抄録集、pp. 90-91(1974).
(注3)丹野直弘、他、「光波反射像測定装置」、日本特許第2010042号(出願1990年).
(注4)D. Huang, et al., "Optical Coherence Tomography," Science, No.254, pp. 1178-1181 (1991).
(注5)Izatt, et al., "Optical Coherence Tomography for Medical Diagnostics," in Medical Optical Tomography: Functional Imaging and Monitoring, Ed. G. Muller et al., SPIE Optical Engineering Press, Vol.IS11, pp. 450-472 (1993).
(注6)Y. Hoshi and M. Tamura, "Detection of dynamic changes in cerebral oxygenation coupled to neuronal function during mental work in man," Neuroscience Letters, Vol.150, pp. 5-8 (1993).
(注7)A. Maki, et al., "Spatial and temporal analysis of human motor activity using noninvasive NIR topography," Medical Physics, Vol.22, pp. 1997-2005 (1997).
(注8)H. Zhao, et al., "Time-resolved diffuse optical tomographic imaging for the provision of both anatomical and functional information about biological tissue," Applied Optics, Vol.44, pp. 1905-1916 (2005).
(注9)Y. Ueda, et al., "Reflectance Diffuse Optical Tomography: its application to human brain mapping, " Japanese Journal of Applied Physics Part 2, Vol.44, pp. 1203-1206 (2005).
(注10)T. F. Massoud and S. S. Gambhir, "Molecular imaging in living subjects: seeing fundamental biological processes in a new light," Genes & Development, Vol.17, pp. 545-580 (2003).
(注11)B. W. Rice, M. D. Cable, and N. B. Nelson, "In vivo imaging of light-emitting probes," Journal of Biomedical Optics, Vol.6, NO.4, pp. 432-440 (2001).
(注12)G. Alexandrakis, F. R. Rannou and A. F. Chatziioanno, "Tomographic bioluminescence imaging by use of a combined optical-PET (OPET) system: a computer simulation feasibility study," Physics in Medicine and Biology, Vol.50, pp. 4225-4241 (2005).
(注13)V. Ntziachristos, J. Ripoll, L. V. Wang, and R. Weissleder, "Looking and listening to light: the evolution of whole body photonic imaging," Nature Biotechnology, Vol.23, pp. 313-320 (2005).
(注14)F. Gao, H. Zhao, Y. Tanikawa, and Y. Yamada, "A linear featured-data scheme for image reconstruction in time-domain fluorescence tomography," Optics Express, Vol.14, pp. 7109-7124 (2006).
(注15)M. Tarumi, et al., "Simulation study of in vitro glucose measurement by NIR spectroscopy and a method of error reduction," Physics in Medicine and Biology, Vol.48, pp. 2373-2390 (2003).
(注16)K. Maruo, et al., "New Methodology to Obtain a Calibration Model for Noninvasive Near-Infrared Blood Glucose Monitoring," Applied Spectroscopy, Vol.60, pp. 441-449 (2006).
(注17)K. Maruo, T. Oota, M. Tsurugi, T. Nakagawa, H. Arimoto, M. Hayakawa, M. Tamura, Y. Ozaki, Y. Yamada, "Noninvasive Near-infrared Blood Glucose Monitoring using a calibration model built by a Numerical Simulation Method -Trial Application to patients in an Intensive Care Unit (ICU)-," Applied Spectroscopy, Vol.60, pp. 1423-1431 (2006).
お問合せ先
科学技術・学術政策局政策課資源室