権利制限に関する論点整理(特許・薬事関係)
平成17年9月30日
文化庁著作権課
 .著作権等管理事業の現状について .著作権等管理事業の現状について
1.主な管理団体について
| |
著作権等管理事業法上の管理事業者 |
|
| 名称 |
日本複写権センター(JRRC) |
学術著作権協会(JAACC) |
日本著作出版権管理システム(JCLS) |
| 対象著作物 |
国内著作物
 |
主として内部利用目的の複写 |
|
国内著作物
(医学系・理工学系の学術誌が中心)
| 海外: |
CCC管理著作物(Elsevierの管理著作物を除く) |
|
国内著作物
(医学系・理工学系の商業出版物が中心)
|
 |
今回問題となるのは、外部提供の事例であるため、関連する管理団体としては、学術著作権協会(JAACC)と日本著作出版権管理システム(JCLS)がある。なお、両管理団体の管理著作物については重複しているものはない。 |
2.著作権等管理事業をめぐる意見について
| ○ |
複写使用料収入は学術研究の高度化と再生産のための原資の一部となっており、受入使用料の減少をもたらす権利制限の拡大は受け入れ難いという意見(製薬企業が行う外部頒布は研究開発等の社内利用の10倍程度あるとの指摘もある)がある。
一方、学術雑誌の複写利用の大部分については、研究開発活動推進に必要な学術情報の購読機関内複写及び購読機関内で保有していないものを得るために行われており、今回の権利制限規定拡大の対象となる特許審査手続や薬事行政を目的とした複写は、研究開発活動を目的とした複写に比べ、遥かに少ないと考えられるため、必ずしも複写使用料収入の減少につながるとはいえないという意見もある。
|
| ○ |
日本著作出版権管理システムについては、事実上権利者の指値による個別単価の積算で支払う方法しか残されておらず、複写利用の調査・報告・支払額のいずれをとっても円滑で合理的・妥当な権利処理であるとは言えないという意見がある。
一方、日本著作出版権管理システムにおいて、権利者の指値を採用するのは、権利者から出来る限り多くの委託を受けるために行っているためであるという意見もある。
|
| ○ |
現在の複写許諾手続きは3団体によって、全て方法が異なり窓口も別々で、利用者にとっては煩雑きわまりないのが実態であるという意見がある。
一方、著作権等管理事業団体においては、将来的課題として、この3団体が一本化されることが望ましく、それぞれが研究を重ねているが、まず窓口の一本化等合意が出来る部分から業務提携を始める努力をしているとのことである。完全な一本化を図るためには、価格決定の合意が不可欠であるが、現在、複写権センターにおいて鋭意検討が進められているとのことである。
|
| ○ |
管理委託物の著作権の所在が不明確であるという意見もある。
これに対しては、学術著作権協会では、学会から複写権の委託を受ける場合、著作権(ごく少数の学会の場合は複写権)の権利者になっていることを条件にしているとのことである。また、日本著作出版権管理システムでは、委託の条件として権利委託を受けているか譲渡を受けているものに限っており、そのような問題はないものと考えているとのことである。 |
3.管理団体のカバー率について
<特許関係>
不明
(参考)
| ・ |
特許手続における平成16年度年間複写件数:約16,000件 |
| ・ |
実用新案手続における平成16年度年間複写件数:2件 |
| ・ |
意匠手続における平成16年度年間複写件数:約500件 |
| ・ |
商標手続における平成16年度年間複写件数:約50件 |
| ・ |
特許協力条約に基づく国際出願における平成16年度年間複写件数:約3,000件 |
|
|
| 【出典:特許庁】 |
<薬事関係>
 |
自然科学系学術団体(学会・協会等)ベース( 推定1,100団体(日本学術協力財団に登録されている自然科学系学術団体数)) 推定1,100団体(日本学術協力財団に登録されている自然科学系学術団体数))
学術著作権協会:約69パーセント(約760団体)【出典:学術著作権協会】
|
|
 |
平成15年度の医学衛生分野の雑誌発行点数(出版社が発行するものに限る)ベース( 466点(2005年度『出版年鑑』)) 466点(2005年度『出版年鑑』))
日本著作出版権管理システム:約77.5パーセント(361点)【出典:日本著作出版権管理システム】
|
 |
科学技術振興機構(JST)ベース(科学技術振興機構(JST)の収集する日本国内の医学関連雑誌9,168誌を分母とする)【出典:日本製薬団体連合会】 |
| |
学術著作権協会 |
日本著作出版権管理システム |
| JMEDPlusデータベース(注) |
約7.2%(656誌) |
約3.3%(305誌) |
| ※ |
全てが薬事手続に利用されるとは限らない。 |
| ※ |
なお、日本著作出版権管理システムがデータベースに登録されている著作物と管理団体で管理している著作物を照合したところ、
|
|
| ・ |
学術著作権協会 3,162点(2005年9月26日現在) |
| ・ |
日本著作出版権管理システム 404点(医学系359点、理工系45点)
|
とのデータを得たとの指摘があった。 【出典:日本著作出版権管理システム】
|
| 注) |
JMEDPlusとは、日本国内の医学系文献情報データベースとされているが、医学系以外の文献も含まれているとの指摘もある。 |
 |
医学中央雑誌データベース(注1)(医学中央雑誌に採択されているものうち、国際標準逐条刊行物番号(ISSN)(注2)が付されている3,415誌を分母とする)【出典:日本製薬団体連合会】 |
|
| |
学術著作権協会 |
日本著作出版権管理システム |
| 医学中央雑誌データベース |
約13.9%(473件) |
約10.7%(367件) |
| ※ |
全てが薬事手続に利用されるとは限らない。 |
| ※ |
医学中央雑誌刊行会の見解として通常複写対象となるのは380誌程度であり、公官庁作成著作物が多く含まれている。【出典:日本著作出版権管理システム】
|
|
| 注1) |
医学中央雑誌データベースとは国内で発行されている医学・歯学・薬学およびその関連領域から収集された資料のデータベースである。 |
| 注2) |
国際標準逐次刊行物番号(ISSN)とは、国際登録センターに登録することによって、個々の逐次刊行物に与えられる固有の識別番号である。 |
|
 |
サンプル調査【出典:日本製薬団体連合会】
| ○ |
副作用・感染症報告制度・治験副作用度に報告において、複写等を行い、国等に提出することについて(薬事行政に係る権利制限の「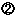 」関係) 」関係) |
|
|
| 学術著作権協会 |
日本著作出版権管理システム |
| (国内文献)21% |
(国内文献)11.7% |
| (海外文献)100% |
(海外文献)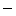 |
| ※ |
大手新薬メーカー(1社)のある1か月分のデータを基に算出。 |
| ※ |
これらの複製は分析・評価するための情報収集用複写が殆どであり、行政当局への提出はこのうち2〜3パーセント程度である。 |
| ○ |
医薬品の製造販売業者は医薬品等の適正使用に必要な情報を提供するために,関連する研究論文等を複写し,調査し,医療関係者へ頒布・提供することについて(薬事行政に係る権利制限の「 」関係) 」関係) |
| 学術著作権協会 |
日本著作出版権管理システム |
| (国内文献)9.2% |
(国内文献)31.0% |
| (海外文献)67.9% |
(海外文献)2.9% |
| ※ |
大手〜中堅の新薬メーカー4社のある1か月分のデータを基に算出。 |
4.諸外国の例について
<特許関係について>【出典:特許庁】
 |
非特許文献を出願人に送付するための審査官による複製について |
|
| 国名 |
該当条文 |
備考 |
| 米国(アメリカ) |
 |
米国(アメリカ)著作権法第107条の「フェア・ユース」に該当。 |
| 英国(イギリス) |
 |
英国(イギリス)著作権法45条において「裁判における手続」における使用のために無償で複製することが許容されており、審査手続きは「裁判における手続」に入ると解釈して運用。 |
| 独国(ドイツ) |
 |
独国(ドイツ)著作権法第45条第1項の、「官庁の手続きにおける使用」の規定により無償で複製することが可能。 |
| 中国 |
 |
著作権法第22条おいて、「国家機関が公務を遂行するために合理的な範囲内において既に公表された著作物を使用すること」は著作権者の許諾なく、無償で行えることとされている。さらに、著作権法実施条例第5条において、使用には複製が含まれることが規定されている。 |
 |
審査官からの書類提出の求めに応じるための非特許文献の出願人による複製について |
|
| 国名 |
該当条文 |
備考 |
| 米国(アメリカ) |
 |
| ・ |
この点についての判例は見つかっていない |
| ・ |
米国(アメリカ)の弁護士の回答の要旨:複製の目的や性質、著作物の価値への影響を勘案すると、米国(アメリカ)著作権法第107条の「フェア・ユース」に該当する。 |
|
| 英国(イギリス) |
 |
・この点についての判例は見つかっていない |
| 独国(ドイツ) |
 |
| ・ |
この点についての判例は見つかっていない |
| ・ |
ドイツ著作権法のコンメンタールには、ドイツ著作権法第45条により複製が許される者に、「関与する当事者」が含まれる点、また官庁の命令は必要でない点が示されている。なお、独国(ドイツ)の弁護士からも同様に、出願人、異議申立人、代理人等が複製を行う場合、求められて行うか自発的に行うかに関わらず、ドイツ著作権法第45条1項における「官庁の手続きにおける使用」のために無償で複製することは許される旨の回答をいただいている。 |
|
| 中国 |
 |
| ・ |
この点についての判例は見つかっていない |
| ・ |
中国の弁護士の回答の要旨:著作権法第22条第1項第二号の「ある問題を説明するため」に該当し、著作権侵害とならない(ただし、全文複製を行わないなど適切に引用することが必要)。もしくは、著作権法第22条第1項第一号の「研究又は鑑賞のために」に該当し、著作権侵害とならない(ただし、非営利性が求められる)。 |
|
 |
特許庁への先行技術文献(非特許文献)の提出による情報提供のための複製について |
|
| 国名 |
該当条文 |
備考 |
| 米国(アメリカ) |
 |
| ・ |
この点についての判例は見つかっていない |
| ・ |
元米国(アメリカ)特許商標庁幹部の回答の要旨:「フェア・ユース」に該当する。 |
|
| 英国(イギリス) |
 |
| ・ |
この点についての判例は見つかっていない。 |
| ・ |
日本と違い、審査官は出願人に文献の提出を命令する権限を持たない。 |
|
| 独国(ドイツ) |
 |
| ・ |
この点についての判例は見つかっていない |
| ・ |
ドイツ著作権法のコンメンタールには、ドイツ著作権法第45条により複製が許される者に、「関与する当事者」が含まれる点、また官庁の命令は必要でない点が示されている。なお、独国(ドイツ)の弁護士からも同様に、出願人、異議申立人、代理人等が複製を行う場合、求められて行うか自発的に行うかに関わらず、ドイツ著作権法第45条1項における「官庁の手続きにおける使用」のために無償で複製することは許される旨の回答をいただいている。 |
|
| 中国 |
 |
| ・ |
この点についての判例は見つかっていない |
| ・ |
中国の弁護士の回答の要旨:著作権法第22条第1項第二号の「ある問題を説明するため」に該当し、著作権侵害とならない(ただし、全文複製を行わないなど適切に引用することが必要)。もしくは、著作権法第22条第1項第一号の「研究又は鑑賞のために」に該当し、著作権侵害とならない(ただし、非営利性が求められる)。 |
|
 |
非特許文献を出願・審査情報の一環として電子的に保存するための特許庁による複製について
⇒該当条文なし |
|
<薬事関係について>【出典:厚生労働省・日本製薬団体連合会】
 |
承認・再審査・再評価制度において,申請書に研究論文等を添付する必要があるため,研究論文等の複写を作成し,国等に提出することについて |
 |
副作用・感染症報告制度・治験副作用報告制度において,期間内に副作用等の発現に係る研究論文等の複写を作成,調査し,国等に提出することについて |
| 欧米いずれの国においても、重篤な副作用に関する症例情報等について、薬の誤使用による影響等についての行政官庁への提出の義務を課している。このように国が提出を義務付けている資料に関しては、ドイツでは、著作権の権利制限の範疇としてとらえている。スペインでは、行政手続において法的な義務に基づく複製は著作権者の許諾は不要であり、イタリアでは、行政当局が明示的に提出を求めた場合には著作権の適用外と解されている。米国(アメリカ)では「fair use」の範疇でとらえられるかどうかは裁判で争うことができるが、法や規則によって強制的にコピーを提供することを義務づけている場合、著作権の侵害とならないとした判例(SmithKline Beecham v. Watson Pharmacenticals,211 F.3d 21 (2nd Cir.2000))(注)がある。 |
| 注) |
FDA(米国(アメリカ)・食品医薬品局)への一般医薬品の承認申請の際に、同一の先行医薬品でFDAの承認を受けているラベル(当該医薬品に付属するパンフレット等も含む)と同一のラベルを、FDAに提出することが義務付けられている事案 |
【例:ドイツの状況】
| 1) |
German Pharmaceuticals Act(日本における薬事法該当法)
| ・22条: |
製造承認申請時には、 その製品に関する活性成分及び他の組成物、 その製品に関する活性成分及び他の組成物、 剤型、 剤型、 効能・効果及び副作用の有無、 効能・効果及び副作用の有無、 作用機序、 作用機序、 毒性、 毒性、 臨床試験結果等に関する書類を提出する。かかる場合、明示的には文献のコピーを添付することを義務付けていないが、ケースにより要求されることもあり、要求されれば提出しなければならない。 臨床試験結果等に関する書類を提出する。かかる場合、明示的には文献のコピーを添付することを義務付けていないが、ケースにより要求されることもあり、要求されれば提出しなければならない。 |
| ・29条: |
報告義務
| * |
製造承認取得者は、引き続き、 製造承認時に提出した書面に関する修正事項、 製造承認時に提出した書面に関する修正事項、 副作用報告、 副作用報告、 他の薬品との相互依存事項、 他の薬品との相互依存事項、 誤使用等について報告をしなければならない。 誤使用等について報告をしなければならない。 |
| * |
副作用、相互依存事項、誤使用等による影響が重篤な場合には、15日以内に報告をしなければならない。 |
| * |
他の場合には、製造承認取得者は、関連する状況を記録した書類を保管し、定期的に報告する。これらは、取得後1年以内は少なくとも6ヶ月毎、3年以内は毎年、6年以降は5年毎にしなければならない。 |
|
| ・ガイドライン: |
法令中は上記に関する詳細な規定はないが、ガイドラインでは、必要に応じての文献コピーの添付を規定している。 |
|
| 2) |
German Copyright Act(著作権法)
| 45条 |
|
制限規定 |
| 1項 |
|
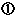 裁判所、仲裁、公共機関における手続に使用される目的での文献のコピーは権利の例外となる。 裁判所、仲裁、公共機関における手続に使用される目的での文献のコピーは権利の例外となる。
| ⇒ |
製造承認取得の目的で作成される書類(文献コピーの添付を含む)は権利制限に中に含まれる。 |
| ⇒ |
さらに、上記手続に使用するために必要な書類を前もって準備し、保管することも許可される。 |
|
| 3項 |
|
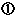 上記 上記 の目的で使用するために提供することも許可される。 の目的で使用するために提供することも許可される。
| ⇒ |
製造承認取得の目的で厚生省に提出することも許可される。
|
 |
さらに、上記 の申請時点で、医師等の意見を求める場合には、当該医師等への提供も許可される。 の申請時点で、医師等の意見を求める場合には、当該医師等への提供も許可される。 |
|
|
 |
医薬品の製造販売業者は医薬品等の適正使用に必要な情報を提供するために,関連する研究論文等を複写し,調査し,医療関係者へ頒布・提供することについて |
| どの国も医療機関への文献提供を明確に義務づけていない。 |
【参考】各国著作権法における参考条文
米国(アメリカ)著作権法 (社団法人 著作権情報センターのホームページより抜粋)
第107条 排他的権利の制限:フェア・ユース
第106条および第106A条の規定にかかわらず、批評、解説、ニュース報道、教授(教室における使用のために複数のコピーを作成する行為を含む)、研究または調査等を目的とする著作権のある著作物のフェア・ユース(コピーまたはレコードへの複製その他第106条に定める手段による使用を含む)は、著作権の侵害とならない。著作物の使用がフェア・ユースとなるか否かを判断する場合に考慮すべき要素は、以下のものを含む。
| (1) |
使用の目的および性質(使用が商業性を有するかまたは非営利的教育目的かを含む)。 |
| (2) |
著作権のある著作物の性質。 |
| (3) |
著作権のある著作物全体との関連における使用された部分の量および実質性。 |
| (4) |
著作権のある著作物の潜在的市場または価値に対する使用の影響。 |
上記の全ての要素を考慮してフェア・ユースが認定された場合、著作物が未発行であるという事実自体は、かかる認定を妨げない。
英国(イギリス)著作権法 (特許庁仮訳)
第45条
| (1) |
議会または裁判における手続のために行う行為は著作権侵害とならない。 |
| (2) |
そのような手続を報告するために行う行為は著作権侵害とならない。しかし、それによって公表された手続に関する報告である著作物の複製を認めるものと解釈されるべきではない。 |
独国(ドイツ)著作権法 (斉藤 博訳、外国著作権法令集(16)-ドイツ編-、社団法人著作権資料協会より抜粋)
第45条 訴訟及び公共の安全
| 1 |
裁判所、仲裁裁判所又は官庁の手続において使用するために、著作物の個々の複製物を作成し、又は作成させることは許される。 |
| 2 |
裁判所及び官庁は、訴訟及び公共の安全のために、肖像を複製し、又は複製させることができる。 |
| 3 |
その複製と同一の要件の下で、著作物を頒布し、公に展示し及び公に再生することも許される。 |
中国著作権法 (社団法人 著作権情報センターのホームページより抜粋)
第22条
次の各号に掲げる場合には、著作権者の許諾を得ずに、その著作権者に報酬を支払うことなく著作物を使用することができる。ただし、著作者の氏名及び著作物の題号を明示するものとし、かつ、著作権者がこの法律に基づいて享有するその他の権利を侵害してはならない。
| (1) |
個人の学習、研究又は鑑賞のために他人の既に公表された著作物を使用すること |
| (2) |
著作物の紹介若しくは論評又は問題説明のために、自己の著作物において他人の既に公表された著作物を適切に引用すること |
| (7) |
国家機関が公務を遂行するために合理的な範囲内において既に公表された著作物を使用すること |
(注:ここでいう「著作物の使用」については、著作権法実施条例第5条に定められており、著作物の複製、発行、出版、翻訳、編集等を含むものである)
 .権利制限を認める場合の条件 .権利制限を認める場合の条件
権利制限を認める場合には、ベルヌ条約に留意する必要がある。ベルヌ条約第9条において権利制限が認められる要件は、以下のとおり。
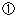 |
特別の場合について |
 |
当該著作物の通常の利用を妨げず |
 |
その著作者の正当な利用を不当に害しないこと |
|
以上の点を踏まえた上で、各個別の論点について、権利制限について検討する必要がある。
<ベルヌ条約:スリー・ステップ・テストの意味>
<スリー・ステップ・テストを踏まえ、検討すべき事項>
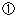 |
「特別の場合」は、制定法において特定の場合に限定することで足りると考えられるが、そのためには、法改正により権利制限を行うべき必要性・緊急性について、検討する必要がある。 |
 |
「当該著作物の通常の利用を妨げず」といえるか否かは、権利制限の結果として、無許諾で利用されたものが競合するか否かが判断されると考えられることから、権利制限により、既存の許諾システムや著作物の流通にどのような影響を与えるかについて検討する必要がある。 |
 |
「著作者の正当な利益を不当に害しないこと」といえるか否かは、権利者の利益を不当に害することになるか否かにより判断されると考えられることから、一般的に考えると権利制限による経済的損失について検証する必要がある。 |
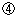 |
以上を踏まえた上で、なお権利制限をするとした場合、どのような条件付けを行うべきかについて検討する必要がある。 |
< 権利制限の必要性・緊急性> 権利制限の必要性・緊急性>
| ○ |
|
対立利益
利用者側については、直接的には特許付与を受ける私人・企業の利益となるが、特許審査手続の迅速・的確な審査という公益性につながるものである。
一方で、著作権も私権であるが、一定の排他的利用権の付与により、文化の発展に寄与するという公益性につながるものである。 |
| ○ |
|
権利制限を認めるべき緊急性の有無 |
< 既存の許諾システムや著作物の流通に与える影響> 既存の許諾システムや著作物の流通に与える影響>
| ○ |
|
現在の利用許諾システムでは対処ができないのか |
| ○ |
|
現行法の解釈・運用では対処できない部分はあるのか
−例えば、図書館等における複製(31条1号)でも対処できない場合はあるのか
−複写を必要とする行政手続自体において配慮する余地はないのか(提出時期等) |
| ○ |
|
著作物の出版に与える影響はあるか |
< 経済的損失> 経済的損失>
| ○ |
|
損失を被る可能性がある関係者
−著作権者(出版社を含む)
−著作権等管理団体 |
| ○ |
|
権利制限により使用許諾料/出版売り上げの減少が見込まれるか |
< 権利制限を認める場合の条件付け> 権利制限を認める場合の条件付け>
| ○ |
|
現行法の解釈・運用や、現在の許諾システムで対処できるものについては除くべきではないか |
| ○ |
|
複製の範囲等(著作物の種類、複製部数、複製ができる場面、複製物の提出先等)について制限をする必要はあるか
−「非特許文献」以外に、どのような限定を設ける必要があるか |
| ○ |
|
損失の填補措置を講じる必要はあるか |
| ◎ |
|
なお、特許審査手続関係については、「意匠」「実用新案」「商標」「国際出願」のそれぞれについても、上記の点について検討することが必要 |
< 権利制限の必要性・緊急性> 権利制限の必要性・緊急性>
| ○ |
|
対立利益
利用者側については、直接的には医薬品等の承認等を受ける私人・企業の利益となるが、医薬品等の品質、有効性等に関する情報や副作用等情報は、国民の生命に関わりうる重要な情報であり、公益性につながるものである。
|
| * |
ただし、製薬企業等による一連の複写利用は、その商品である医薬品等の承認と継続販売に必要な法令上の手続、あるいは利用者への情報提供であり、製薬企業等が営業を継続するために必要な行為であって、公益性は低いのではないかという指摘もある。
|
一方で、著作権は私権であるが、一定の排他的利用権の付与により、文化の発展に寄与するという公益性につながるものである。 |
| ○ |
|
権利制限を認めるべき緊急性の有無 |
< 既存の許諾システムや著作物の流通に与える影響> 既存の許諾システムや著作物の流通に与える影響>
| ○ |
|
現在の利用許諾システムでは対処ができないのか |
| ○ |
|
現行法の解釈・運用では対処できない部分はあるのか
−例えば、図書館等における複製(31条1号)でも対処できない場合はあるのか
−複写を必要とする行政手続自体において配慮する余地はないのか(提出時期等) |
| ○ |
|
著作物の出版に与える影響はあるか |
< 経済的損失> 経済的損失>
| ○ |
|
損失を被る可能性がある関係者
−著作権者(出版社を含む)
−著作権等管理団体 |
| ○ |
|
権利制限により使用許諾料の減少/出版売り上げが見込まれるか
|
| ⇒ |
|
学術著作権協会によると、2004年の複写実態によれば、薬事法関連では国内著作物の複写使用料は16百万円であり、CCC著作物の複写使用料は328百万円である。 |
| ⇒ |
|
日本著作出版権管理システムの推計では、約7〜8億円 |
|
< 権利制限を認める場合の条件付け> 権利制限を認める場合の条件付け>
| ○ |
|
現行法の解釈・運用や、現在の許諾システムで対処できるものについては除くべきではないか |
| ○ |
|
複製の範囲等(著作物の種類、複製部数、複製ができる場面、複製物の提出先等)について制限をする必要はあるか |
| ○ |
|
損失の填補措置を講じる必要はあるか
| − |
なお、「医薬品等の製造販売業者は医薬品等の適正使用に必要な情報を提供するため関連する研究論文等を複写し,調査し,医療関係者へ頒布・提供すること」の実態は、厚生労働省・日本製薬団体連合会によると、医療関係者の求めに応じて、緊急な情報提供するためであり、新薬の販売や医薬品の説明書・添付文書等の根拠文献としてのための複写については、個別に著作権処理されたものを用意する場合が殆どであるとされている(⇒ただし、日本著作出版権管理システムに対して、このような使用目的の申請はないため、「殆ど」か否か不明であるとの指摘がある)。
また、医薬関係者の個人的研究や著作目的等の要求に応じて製薬会社が複写文献等を提供することは、公正競争規約、プローモーションコード等で規制されており、実施できないとされている。 |
|
|
