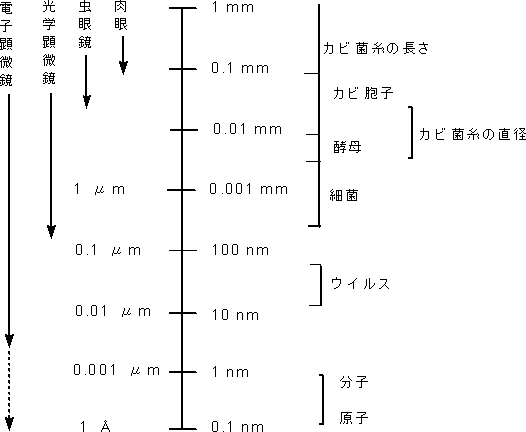
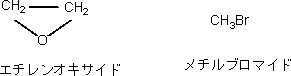基礎編1.カビとは1−1 微生物の大きさ地球上に最初に誕生した原始的な単細胞生物は長い時間をかけたさまざまな進化の過程をたどり、現在の高等動植物までに進化してきた。しかし、一部の生物は進化の過程で今なお単細胞あるいは数個の細胞から構成されている小さな生物としてとどまっており、顕微鏡によりやっと見える微小な生物群を微生物と定義している。このような微生物の中には単独では増殖することができない最も小さなウイルスを含めて原核細胞の細菌、真核細胞の酵母およびカビが存在する(図2)。
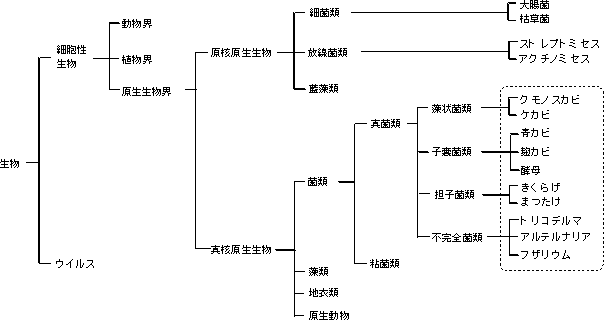
細菌や酵母は培養液中や寒天平板上で大量に増殖させた場合には濁りとして、あるいはコロニー(細胞の集合体)として観察されるが、個々の細胞の微細な形状は肉眼では全く見えない。また、カビについても菌糸や胞子の集団あるいは担子(キノコ)は見ることができるが、微細構造については見ることができない。光学顕微鏡下では細菌およびカビの大まかな形態観察が可能であるが、ウイルスや細菌およびカビの表面の微細構造は走査型電子顕微鏡を用いなければ観察することができない。したがって、カビなどの増殖初期には通常は肉眼では全く観察できないことに注意を要する。 1−2 カビの分類学的位置 生物は自己増殖をする細胞性生物と自己増殖機能を持たないウイルスに大分類することができる。微生物は細胞性生物の中の下等な原生生物界に分類され、細胞壁を持つことから植物に近い構造を有している。さらに、微生物細胞内に核を持たない原核原生生物(DNAが原形質内に存在)と核を有する真核原生生物(DNAが核内に存在)に分かれる。前者の原核原生生物の中に細菌類が属し、後者の真核原生生物の中にカビ類が分類される(図3)。微生物を栄養源的に分けると炭素源として炭酸ガスを利用可能な独立栄養微生物と炭素源を有機物に依存する従属栄養微生物に分けられるが、カビは従属栄養微生物であり葉緑体は持っておらず、炭素源を有機物から獲得するため、セルロース、ヘミセルロースなどの繊維質や糖質およびタンパク質を分解し、利用(資化)する。
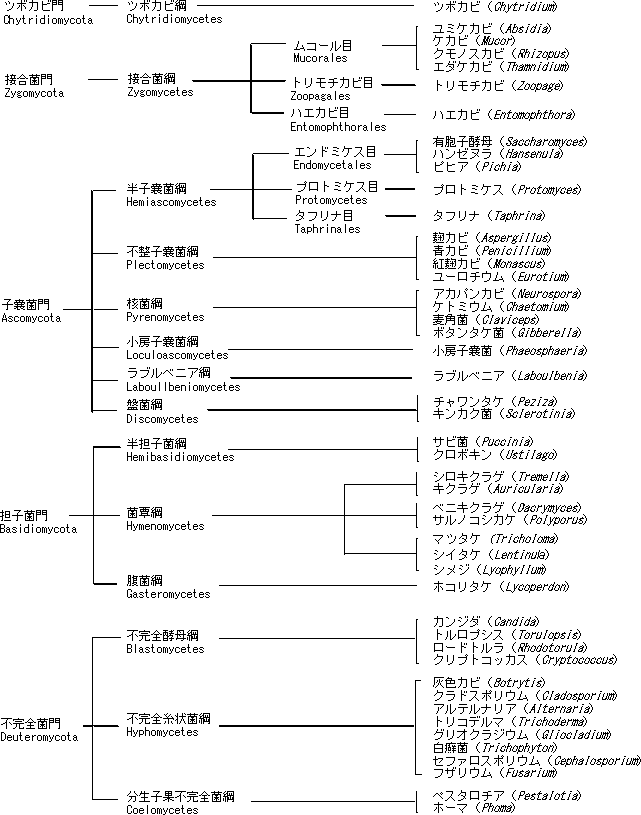
現在、カビは80,000種以上確認されているが、生きているが培養できない種類(VNCあるいはVBNCと略:viable but non-culturable)も加えると、今後新たに発見される種類は増加すると思われる。
1−3 カビが資料に与える影響カビは、表1で述べたように衣食住や工業製品のほとんどを栄養源として分解・劣化させる。さらに、カビは天然有機物や人工有機物のみならず無機物や鉱物までも栄養源としており、博物館・図書館等の資料などは格好の栄養源(炭素源、窒素源)として物理的、化学的に分解(破壊)される。特に、木質系、天然繊維系、皮革系および膠等は経年劣化(物理的劣化・化学的劣化)した場合には、資料素材が本来持っていた僅かの抗菌性物質(テルペノイド、リグニン、フラボノイド、芳香族化合物、精油成分、抗菌性色素等)が分解あるいは蒸散して減少しているため、細菌やカビによる微生物劣化を容易に受ける。さらに、カビ類は有機性染料(植物由来、動物由来)を含む全ての天然有機物を分解する酵素群を有しており、酵素分解により資化し、カビの細胞増殖の原料として利用する。したがって、カビ被害は不可逆的(一方通行)な生物反応で、決して元に戻らない劣化であることに改めて注意する必要がある。 2.カビの生理生態と生育環境2−1 カビの生育環境<水分>微生物の生育に水分が不可欠であり、水が全く存在しない環境では全ての微生物が生育不可能である。物質中に含まれている水は通常は遊離水(自由水)、結晶水、水素結合水、水和水(タンパク質、糖質、脂質、その他との水和)および氷の状態で存在しているが、微生物が利用可能な水分は自由水のみである。すなわち自由水とは、環境の温度、湿度の変化で容易に移動、蒸発および氷結が起こる水である。自由水が減少すると生育速度の低下や生育が停止するなど自由水は微生物の増殖に非常に重要な因子となっている。自由水を定量的に表す指標として水分活性(Aw:water activity)が用いられている。Awは本によってはawと記載されている場合もある。
実際の測定は試料を入れた密閉容器内が平衡状態に達した時の湿度(平衡相対湿度:ERH、Equilibrium Relative Humidity)を測定することにより水分活性を求めることができる。
すなわち、試料を入れた密閉容器内の平衡相対湿度が90パーセントならば、Awは0.9となる。なお、大気中の湿度は相対湿度(RH:Relative Humidity)で表される。一方、大気中の水分は温度が低下することにより飽和水蒸気圧が低下し、結露が起こる。この結露が起こる温度を露点といい、特殊な露点温度計や電気抵抗値で自動計測することができる。資料等の収納庫や展示ケース内では環境中の水蒸気と常に平衡状態が保たれているため緩やかな温度変化には結露への影響が少ないが、急激な温度変化により結露や水分活性が上昇し、カビ等の生育可能領域に入ると増殖が始まる。これらについてはカビの制御方法のところで解説する。 表2 微生物の生育可能な最低Aw
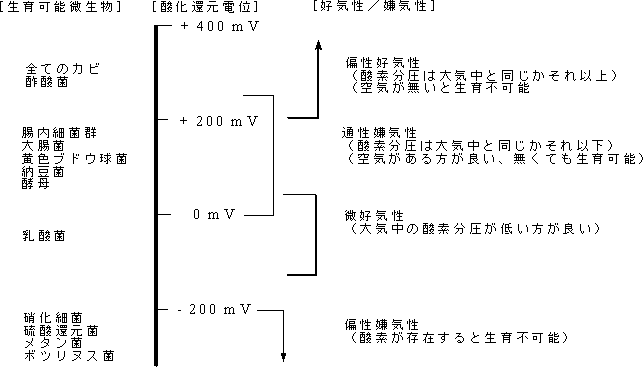
<酸素>微生物には、生育に酸素を必要(好気的呼吸)とするものと必要としない(嫌気呼吸)ものが存在する。カビは空気(分子状の酸素)の存在無くして生育不可能である。一方、メタン菌やボツリヌス菌などは酸素が全く存在しない環境でのみ生育可能である。このように酸素を必要とする性質と必要としない性質を好気性および嫌気性と言う。微生物の生育環境を環境気体中の酸素分圧(酸素濃度)や水中あるいは水を多く含む物質中では酸化還元電位(ORP:Oxidation Reduction Potential)で表すことができる(図6)。カビや酢酸菌は偏性好気性菌(絶対好気性菌とも言う)に属し、生育のための酸素分圧条件は大気中と同じかそれ以上必要である。言い換えると空気が無いと生育できない。したがって除酸素や窒素置換した環境では全く増殖できない。資料を厚手のポリエチレン袋に入れ、脱酸素剤を入れ密閉シールすると簡単に無酸素環境にすることができる。しかし、無酸素あるいは窒素環境下においてもカビ胞子は死滅せず生存しており、酸素環境条件が調うと直ちに発芽して増殖をすることに注意を要する。腸内細菌群(大腸菌の仲間)や酵母類は通性嫌気性菌であり、酸素が存在する方が良く生育するが、酸素が無い状態(大腸内の環境)でも生育可能である。また酵母類は酸素が無くなると嫌気呼吸(発酵)によりエネルギーを獲得する。偏性嫌気性菌(絶対嫌気性菌とも言う)は、分子状酸素(気体状酸素)あるいは酸化体の濃度が高い環境では全く生育できない。
ORP(E)は、以下に示すネルンストの式によって与えられる。すなわち水に溶けている酸化体と還元体の活量の比の自然対数と気体常数、絶対温度およびファラデー数と標準電極電位で与えられる。
実際の測定は、白金電極と飽和カロメル電極(SCE)からなる酸化還元電位計により簡単に測定できる。低い酸化還元電位や低い酸素濃度を利用したカビの生育制御は空気中の酸素濃度、水中では酸化還元電位の測定を継続的に行いカビの生育条件領域外に環境を維持する必要がある。 <炭酸ガス>非常に低濃度の炭酸ガスは、好気性微生物の生育促進作用があるが、大気中の炭酸ガス分圧が通常環境よりも高くなると生育阻害作用を示すようになる。さらに、微生物の呼吸に伴って発生した炭酸ガスの排出圧よりも、外部の炭酸ガス分圧を高くすると強い呼吸阻害を起こして増殖が停止する。また、純炭酸ガス雰囲気下では、特にカビなどの偏性好気性微生物は炭酸ガスの作用と無酸素状態の相乗的な働きにより、増殖が完全に停止する。 <窒素およびアルゴン>前述したが、空気を窒素ガスやアルゴンで置換すると好気性微生物は呼吸が停止し、増殖が強く阻害される。偏性好気性のカビの生育抑制には、不活性ガスである窒素およびアルゴン置換が有効である。 <温度>生育可能温度で微生物を大まかに分類すると、0度近傍を最適温度領域とし20度以上では増殖できないものを好冷菌、20〜45度を最適温度領域としているものを中温菌、45〜60度を最適温度領域としているものを好熱菌、60〜80度を最適温度領域としているものを高度好熱菌および90〜100度を最適温度領域としているものを超好熱菌となる。カビ、酵母及び細菌の生育可能温度と最適生育温度を表3に示す。なお、凍結すると前述の自由水が氷結し、利用可能な水分が存在しなくなるため増殖が停止する。しかし、カビ胞子や細菌芽胞などは生存していることに注意しなければならない。 表3 微生物の生育可能温度領域と最適生育温度
微生物の極限環境と言われる0度近傍や100度近傍を除外すると、通常のカビや酵母は0度以下または40度以上にすると生育不可能である。しかし、0度近傍では生育速度が非常に遅いが、半年あるいは数年後に目視で観察されるまでに生育する低温カビも存在するので、冷蔵保存する場合には特に注意を要する。 表4 カビの耐熱性
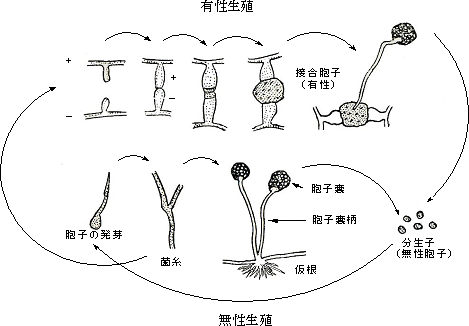
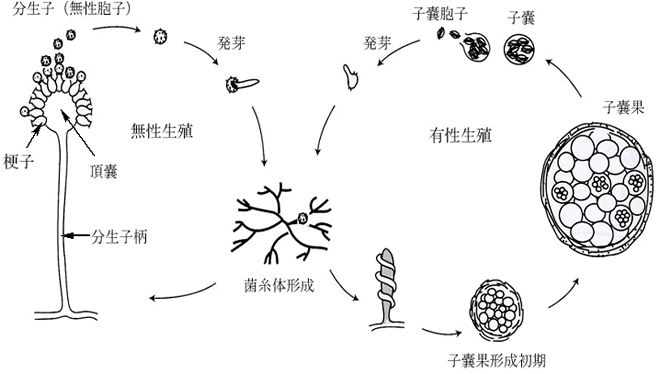
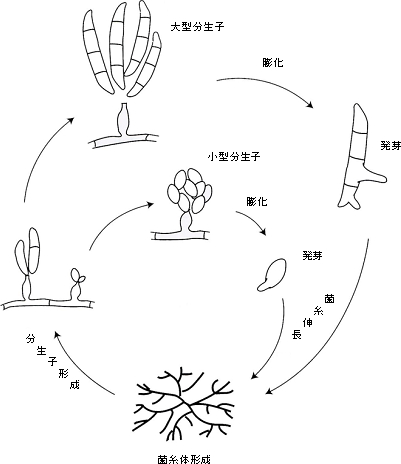
しかしながら乾熱(乾燥状態での加熱)では、カビ胞子(分生子、子嚢胞子、接合胞子、厚膜胞子)を死滅させるには120度以上で60〜120分程度の加熱時間を必要とし、非常に耐熱性が高い。したがって、資料上に付着あるいは生育したカビの加熱殺菌は不可能であることがわかる。 <pH(ペーハー)> 水素イオン濃度(pH(ペーハー))は、生物細胞内の生化学反応に重要な環境因子の1つである。pH(ペーハー)環境により生物を分類すると、好中性生物(pH(ペーハー)5〜9に至適増殖領域を示す生物。大半の高等生物がここに含まれる。)、好酸性生物(pH(ペーハー)5以下に至適増殖領域を示す生物。極端な酸性条件では、生化学反応の調節の乱れやタンパク質の変性が見られるが、これらの条件に耐えうる生化学的資質を有する好酸性菌など。)、および極限環境中にはpH(ペーハー)1以下の条件で至適増殖領域を示す生物(古細菌)も存在する。 <圧力>細菌や酵母の懸濁液を圧力容器に入れ、室温下で圧力(静圧)を上昇(20〜40MPa(メガパスカル))させると細胞内タンパク質が徐々に変性(水素結合の切断による凝固)し、これに伴って生育速度が低下する。さらに圧力を高める(80〜100MPa(メガパスカル))と死滅する。 2−2 カビの生理生態<カビの生活環> 接合菌類や子嚢菌類は、有性と無性の2種類の生活環(life cycle)を持つものと不完全菌のような比較的単純な生活環を持つものが存在する。
<寿命>カビの寿命は形態や器官(分生子、子嚢胞子、接合胞子、厚膜胞子、菌糸)により大きく異なる。胞子の寿命は非常に長いが菌糸はかなり短い。通常の寒天平板上では、培養後1ヶ月経つとコロニーの周辺部の菌糸は生存しているが、コロニーの中心部の胞子形成した株の菌糸は死滅している場合が多い。斜面培養したカビ菌糸の乾燥を防ぐため高湿下において13〜15度で保存した場合、おおよそ1〜3年で菌糸は死滅する。一般に、菌糸は過度の乾燥下あるいは氷結温度付近では数週間で死滅する。 <栄養源>カビは細菌に比較して非常に多種多様の栄養源で生育することができる。まず炭素源では単糖類(グルコース、フラクトース、マンノース、ガラクトース等)、二糖類(サッカロース、マルトース等)、オリゴ糖(メリビオース)および多糖類(澱粉、セルロース等)を利用する。澱粉糖化酵素やセルロース分解酵素を細胞外に分泌し、単糖あるいはオリゴ糖にまで加水分解して吸収する。窒素源として無機窒素(塩化アンモニウム、リン酸アンモニウム、硝酸アンモニウム、硫酸アンモニウム等)および有機窒素(各種アミノ酸、タンパク質)を利用する。また、リン酸塩、硫酸塩やミネラル(鉄、マンガン、マグネシウム、カルシウム、カリウム、ナトリウム等)を必要とする。 <カビ酵素の産生>一般に、酵素は生物体内反応の全てを起こすタンパク質触媒であり、これら代謝反応に関与する酵素は、生体膜(細胞膜や細胞小器官の膜)に結合している膜酵素、細胞質や細胞外に存在する可溶型酵素に分類される。可溶型酵素のうち、細胞外に分泌される酵素を特に分泌型酵素と呼ぶ。酵素はその触媒機能により酸化還元酵素、転移酵素、加水分解酵素、リアーゼ、イソメラーゼ、リガーゼに分類されているが、細胞外に分泌して作用する酵素の中でも特に注目すべきはタンパク質、脂質、多糖(炭水化物やセルロース)を加水分解する多種多様の酵素群(プロテアーゼ、ペプチダーゼ、リパーゼ、セルラーゼ、アミラーゼ等)である。カビがこれらの酵素群を細胞外に分泌し、タンパク質、脂質、糖質から加水分解作用により低分子化合物(アミノ酸、グルコース、マルトース、グリセリン、脂肪酸等)に分解した後、吸収して栄養源としている。 <カビの色素産生>最も有名なカビ色素である紅麹カビ黄色素や赤色素は紅麹カビ(Monascus purpureus)が産生し、食品添加物として使用されている。しかし、大多数のカビは赤色、橙色、褐色、赤褐色、黄褐色、黄色、淡黄色、紫紅色等の様々な色素を産生する。一方、胞子は黒、黒褐色、褐色、緑色および白色のものが多く見受けられる。資料表面上に発生したカビは、既に組織内部にまで菌糸を伸張し、生育に伴って上記のような色素産生および着色胞子を着生し、資料に重大な汚染と影響を与えている。カビの産生色素や胞子による着色は化学的除去や物理的除去が非常に困難である。 3.カビの分離、観察と簡易同定法およびカビ制御方法3−1 カビの分離・採取方法<付着カビの採取方法>通常の保存スラント(斜面培地)からの採取は、先端を鍵型に曲げた白金線(ニクロム線でも良い)を用いて行う。しかし資料等に着生している菌糸や胞子は、前もって30倍程度の手持ち小型顕微鏡あるいはルーペで十分に観察した後、注意深くピンセットで採取し、プレパラートに置きカバーガラスで覆って顕微鏡観察する。場合によっては、プレパラート上に採取したサンプルに水をマイクロピペットにより数十マイクロリットル程度添加して観察してもよい。資料が強靱で表面が破損しないことが確認できればセロテープを資料に優しく押しつけて採取し、プレパラートに貼り付けて検鏡することもできる。 <空中浮遊カビの採取方法>資料の展示施設や保管庫内の空中浮遊カビは、寒天平板培地あるいはプラスチックプレート寒天培地(寒天を充填したプレート)をセット可能な電池式エアーサンプラーを用いて一定時間(一定容積の空気)吸引し、その寒天平板培地あるいはプラスチックプレート寒天培地を27度で2〜7日間培養する。培養後カビ数の計測とコロニー形態を観察する。寒天培地やプラスチックプレート寒天培地に捕集したカビの培養にはインキュベーター(培養器)を使用するが、通常、冷却と加温により温度調節を行う冷蔵庫タイプが多く、庫内が乾燥するのでインキュベーター内にプラスチック容器に水を入れておく方が良い。 <落下カビの採取方法>施設内の落下カビは、寒天平板培地を測定すべき室内の床上60〜70センチメートルに置き一定時間蓋を外して落下菌を採取する。落下菌が多い環境では20分程度、少ない環境では1時間程度蓋を開いておく。蓋を閉じた後、27度で2〜7日間培養する。培養後カビ数の計測とコロニー形態観察をする。 <カビ採取や培養した後の培地や容器の後処理方法>カビ採取に用いたピンセットや白金線は、ガスバーナーの外炎中で付着したカビを殺滅する。一方、観察の終わった寒天平板やプラスチックプレート寒天培地はオートクレーブ(加圧蒸気殺菌装置)を用いて121度、15分間殺菌処理した後に廃棄(医療廃棄物として)する必要があり、決してそのまま廃棄してはならない。オートクレーブが無い施設ではカビの採取と顕微鏡観察のみ行い、培養等は専門家に任せた方が良い。また、安全キャビネットが設置されていない施設では、カビの培養を行ってはいけない。 3−2 カビの観察<カビの目視観察>カビの観察は目視による直接観察が重要であり、特にカビが生育した資料が植物系、動物系、木質系、樹脂系、無機系素材であるのか、変色の程度や色調および臭気によりカビである判断や種類も推定可能である。次に、ルーペあるいは小型手持ち顕微鏡で観察すると菌糸の状況あるいは胞子着生状況が明確になる。 <カビの検鏡観察>実体顕微鏡の資料台に置くことが可能な資料は、実体顕微鏡観察を実施する。なお、各種波長のLEDランプ照射下での観察は、カビ菌糸の蛍光により判定が容易となる。最後にカビをプレパラートに採取して、光学顕微鏡、蛍光顕微鏡さらには微分干渉顕微鏡により詳細な観察を行う。 3−3 カビであるのかの判定法<カビと蜘蛛の糸、糸状や針状の無機結晶、繊維およびその他との判定>菌糸と思われる資料を注意深くピンセットにより採取し水に入れ、速やかに沈殿あるいは溶解すれば、無機結晶であると判定できる。沈殿や溶解しない資料については、培養法およびATP(アデノシン三リン酸)の存在を確認するとよい。生きているカビ菌糸細胞内にはかならずATP(アデノシン三リン酸)を保有しており、細胞が死滅すると細胞内ATP(アデノシン三リン酸)加水分解酵素により速やかに分解されるので、ATP(アデノシン三リン酸)が存在しない。 <培養法>採取したカビと思われる資料をカビ用培地(サブロー寒天培地、ポテトデキストロース寒天培地あるいはツァペックドックス寒天培地等)に接種し、1〜7日間培養後にカビであるかの判定を行うが、培養時間を必要とし、かつVNC(生きているが培養できない)化した菌糸や胞子には適応できない。また、前述したが、オートクレーブ、安全キャビネット、廃棄物処理の契約やその他カビを安全に取り扱うことのできる施設以外では、カビの培養をしてはならない。 <細胞内ATP(アデノシン三リン酸)量の測定>ATP(アデノシン三リン酸)は地球上至る所に存在し、特に人の皮膚上や手で触れた器具などには多量のATP(アデノシン三リン酸)が付着している。また高い耐熱性を有していることより、沸騰水加熱やオートクレーブ処理でも分解しない極めて高い安定性を有している。したがって、採取した資料容器内や菌糸表面に付着しているATP(アデノシン三リン酸)をATP(アデノシン三リン酸)分解酵素により完全に分解した後、ATP(アデノシン三リン酸)を抽出試薬により抽出し、発光試薬(ルシフェリン、ルシフェラーゼ、pH(ペーハー)緩衝液などを含む)を加えてルミノメーターで発光量を測定する。菌糸や胞子の外部に付着しているATP(アデノシン三リン酸)を除去する操作により細胞内ATP(アデノシン三リン酸)のみが検出できる。このATP(アデノシン三リン酸)測定法により生きている菌糸と胞子が検出可能となる。また培養が困難であるVNC化した菌糸や胞子でも検出することが可能である。なおATP(アデノシン三リン酸)測定に必要とする時間は約30分程度であり、迅速的測定方法である。 3−4 カビの簡易同定法<目視による簡易同定>カビの同定は熟練しないとかなり難しい。資料等に着生しているカビを、培養せずに目視のみで同定することは、極めて困難である。しかし、採取した後、純粋培養したカビについて、簡単なものは目視のみで同定が可能である。シャーレ上に形成したカビコロニーの形状、菌糸の色、胞子の色、コロニーの盛り上がり方、綿状、粉状および産生色素等により判定する。この方法では、分類学上でいう、カビの門および綱が判定できる程度である。 <光学顕微鏡による形態学的簡易同定> ここでは非常に簡単な同定方法について図4および図7に示した接合菌のケカビ目(Mucorales)のクモノスカビやケカビを例として説明する。 <遺伝子解析による同定>カビの細胞内にはDNAの遺伝情報をもとにタンパク質を合成する場所と機能を提供するリボゾームを有している。このリボゾームは、大きさの異なる5S(スヴェドベリ)、5.8S(スヴェドベリ)、18S(スヴェドベリ)、28S(スヴェドベリ)(S(スヴェドベリ)は沈降係数)から構成されており、これらをコードしているのがrDNAである。これらの遺伝子の特定領域を、遺伝子増幅方法であるPCR(ポリメラーゼ連鎖反応)により増幅し、比較解析することによりカビの分類・同定が可能である。現在、遺伝子解析を行う企業が多数設立されており、容易にカビの分類同定が可能となった。 3−5 カビの保存方法現場から採取し、平板寒天培地に生育させたカビは通常の場合、3ヶ月以上保存することが難しい。また、カビの種類にもよるがスクリューキャップ付き試験管での寒天斜面培地の場合でも恒温高湿下(13度、湿度90パーセント以上)で1年程度が保存の限界である。したがって定期的に新しい培地に移植し、培養、保存を繰り返す必要がある。詳細なカビの継代や保存については「かび検査マニュアルカラー図鑑」等の参考文献を参照してください。 3−6 カビの制御方法1)物理的制御<電磁波>電磁波照射による微生物制御はガンマ線および紫外線が用いられている。ガンマ線はエネルギーが高く、透過性に優れているので、一般的には密閉包装されたプラスチックの医療器具(注射器、試験管)、シャーレなどの滅菌に使用されている。通常は60Co(コバルト60)および137Cs(セシウム137)などの密封放射性アイソトープからのガンマ線を用いる。ガンマ線照射法はカビのみならず細菌やウイルスなども確実に滅菌することが可能である。しかし、ガンマ線による資料の劣化も大きいため、風水害などによる大量の資料汚染が起きた場合にのみ緊急避難的に利用することが望ましい。ガンマ線被爆を受けると生死に関わる重篤な害をおよぼすので、この方法は完全に遮蔽された照射室を持ち、かつ許可された施設が必要である。 <電子線>電子線は粒子線であるためガンマ線やエックス線と異なり、物質にもよるがその透過力には自ずと限界がある。電子線照射滅菌の殺菌メカニズムは、微生物細胞内の水分子が照射された電子と結合し、励起された結果、殺菌力の非常に強いヒドロキシルラジカル(・OH)が発生し、細胞内でラジカル連鎖反応により遺伝子、タンパク質などを変性、破壊することにより殺滅する。しかし資料への劣化影響も大きいので前述のガンマ線と同様、使用は緊急時にのみに限定する必要がある。 <紫外線>紫外線は260〜280ナノメートルの紫外線ランプにより発生させることができるが、物質を透過する力は極めて弱く、物体の表面に存在する微生物のみを殺滅することができる。微生物が菌塊を形成している場合には陰となる部分では全く殺滅されない欠点がある。さらに紫外線照射は資料に対する劣化影響が大きいので殆ど使用されていない。 <熱>カビの耐熱性については温度の項で解説したがカビ菌糸のみを殺滅するのは比較的低温(80度、30分)加熱で良いが、分生子、子嚢胞子、厚膜胞子などの耐熱性細胞は120度、2時間以上の加熱が必要であるので資料や記念物に応用しない方が良い。なお、加熱方法としてはマイクロ波加熱、赤外線加熱および熱気流加熱がある。 <低温> 低温を用いたカビ制御方法は物質の自由水含量にもよるが <遮断(クリンルーム)>一度、滅菌した資料の再微生物汚染を防止することにより、カビの発生を防ぐことができる。展示ケース内の無菌化や無菌空気雰囲気で保存するのも一つの方法であるが費用がかさむ。 2)化学的制御化学的なカビの制御方法としては、前述した除酸素、窒素、炭酸ガスやアルゴン置換、pH(ペーハー)、酸化還元電位などの利用が考えられるが資料や記念物においては、いずれも適用が困難である場合がほとんどである。しかし水溶性の高い防カビ剤や殺カビ剤は取り扱いが容易であることより、利用されている場合もある。ここではカビに効果の高い薬剤に限定して記載した。しかしカビに対して強い殺カビ性や増殖阻害作用を示す薬剤は少なからず人体に対する毒性や環境毒性を有しており、使用に当たってはMSDS(化学物質等安全性データシート)を詳しく読み、使用後にはMSDSに指定された方法で処分しなければならない。 <エチレンオキサイド>ガス殺菌剤の主なものとしてエチレンオキサイドとメチルブロマイドの化学式を図10に示した。前者の別名は酸化エチレンガス、エチレンオキシド、オキシランと称される。高圧ガス、可燃性ガスで急性毒性物質である。毒性は酸化エチレンガスを短時間に多量に吸入した場合、急性中毒症状として頭痛、悪心、脱力、嘔吐が起こる。重症の場合は肺水腫、神経症状として意識障害、協調運動障害、眼への影響(白内障)が現れることがある。慢性暴露障害としては末梢神経障害、発癌性、生殖毒性が存在する。作用メカニズムはエチレンオキサイドによるDNAの断片化やタンパク質のアルキル化により細菌、カビ、ウィルスを殺滅する。使用方法はオートクレーブと異なり滅菌する資料を一部分が通気性のあるシールパックに入れて加圧・減圧耐性滅菌器に入れ、減圧後エチレンオキサイドガスを注入し、16〜20時間かけて滅菌し、その後エチレンオキサイドを減圧除去する。一般のエチレンオキサイドガス滅菌器は減圧、ガス充填、減圧が自動的に行われる。 <メチルブロマイド>別名は臭化メチル、ブロムメチル、メチブロと称され、沸点が4度、通常の温度域では気体で存在する。これまでは大部分の用途が土壌殺虫剤・殺菌剤として使用されてきたが、オゾン層の破壊物質の一つであることより、日本国内では2005年以降使用が禁止された。ヒトに対する吸入毒性は非常に高く、頭痛、めまい等をおこし、数時間から数日後に痙攣や視力障害等の神経障害をおこす。高濃度暴露では肺水腫をおこし、呼吸麻痺、循環器障害を伴う中枢神経系の機能低下により、死亡することがある。細菌、カビ、ウィルスの殺滅作用に加えて殺虫効果も非常に高い。作用メカニズムは生物に対してアルキル化剤として作用する。
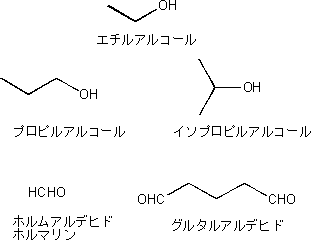
<エチルアルコール>カビに対して使用が可能なアルコール類およびアルデヒド類の化学構造式を図11に示した。エチルアルコールは揮発性と可燃性が高いので特に注意が必要である。エチルアルコールの作用メカニズムは微生物細胞膜への浸透により細胞膜が破壊され、タンパク質の溶出や変性が起こり殺菌効果を示す。したがってエチルアルコールの場合には70w/w%(重量パーセント)(約80v/v%(容量パーセント))の場合が最も高い殺菌力を発揮し、この濃度域より高くなっても低くなっても殺菌効果が激減する。この理由は細胞表層の膜と同じ疎水性にアルコール水溶液を調製すると浸透性が高くなり、高い殺菌活性を示すことに基づいている。エチルアルコールは栄養型の細菌には有効だが、細菌芽胞、真菌や酵母に対しては長時間の接触が必要である。なお、最小発育阻止濃度(MIC)は黒麹カビ(Aspergillus niger)、青カビ(Penicillium notatum)に対して、5パーセント濃度において48時間接触条件で生育を阻害する。エチルアルコール濃度を70パーセントに保ち(蒸発を防ぎ)長時間接触させることでカビを殺菌することが可能だが、エチルアルコールを栄養源とする酢酸菌やその他の微生物の存在により消費されてしまう欠点がある。 <プロピルアルコール、イソプロピルアルコール>プロピルアルコールおよびイソピロピルアルコールもエチルアルコールと同様に細胞内へ浸透しやすい濃度(細胞表面疎水性と同じような疎水性)にすると殺菌活性が高くなる。 <ホルムアルデヒド、ホルマリン>ホルムアルデヒド燻蒸は初期の空間内濃度1,000〜3,000ppm(パーツパーミリオン)とし、最低濃度を600ppm(パーツパーミリオン)以上で7時間以上、湿度70パーセント以上を維持すると細菌、細菌芽胞、真菌、ウィルスおよび原虫等の全てが殺滅され、所期の目的が達成できる。しかしホルムアルデヒドガスは変異原性が陽性、吸入毒性と経皮毒性が高く、皮膚感作性が陽性、眼刺激性が高いことより、ホルムアルデヒドガスを用いた燻蒸や殺菌には取り扱いや廃棄に細心の注意が必要である。人体に及ぼす危険性、環境への負荷などが問題となりホルムアルデヒドガス燻蒸は極めて少なくなった。なお、ホルマリンは35〜38パーセントホルムアルデヒド水溶液(無色、強い刺激臭)であり、真菌、細菌、原生動物に対して高濃度(原液の100倍希釈液)では非常に高い効果を示す。黒麹カビ(Aspergillus niger)およびカンジダ(Candida albicans)に対しては(0.05パーセント)500ppm(パーツパーミリオン)以上で増殖抑制効果を示す。 <グルタルアルデヒド>グルタルアルデヒドは通常2〜20パーセント水溶液が殺菌に使用され、主に医療機器(内視鏡)の殺菌消毒に利用されている。2パーセント水溶液は細菌、真菌、ウィルスを15秒で殺滅し、芽胞を60分の接触で殺滅する。グルタルアルデヒドは毒性(変異原性が陽性、皮膚刺激性が強い、皮膚感作性が陽性)が高く、人体には使用できない。作用メカニズムはチオール基の酸化、アミノ酸との反応、DNA合成阻害作用を示す。また、アルデヒド類は酸性やアルカリ性下ではアルドール縮合(アルデヒドが脱水反応によりアルデヒド基とヒドロキシル基を持った不飽和化合物を生成する反応)を引き起こす。アルデヒド類の殺菌メカニズムはTCAサイクル(トリカルボン酸サイクル)中の脱水素酵素を特異的に阻害し、タンパク質の合成阻害作用を示す。しかし、グルタルアルデヒドは電子顕微鏡の資料作製には無くてはならない固定化試薬でもある。
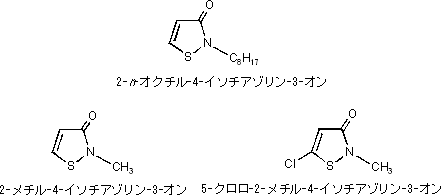
<イソチアゾリン系>イソチアゾリン系薬剤の主な化合物の化学構造式を図12に示した。イソチアゾリン系殺菌剤の中で2-n-オクチル-4-イソチアゾリン-3-オンは黒麹カビ(Aspergillus niger)では8ppm(パーツパーミリオン),青カビ(Penicillium funiculosum)では1ppm(パーツパーミリオン)、カンジダ(Candida albicans)では2ppm(パーツパーミリオン)の非常に低いMIC(最小発育阻止濃度)を示し、強い効果を有する。一方、5-クロロ-2-メチル-4-イソチアゾリン-3-オンと2-メチル-4-イソチアゾリン-3-オンの混合物はAspergillus niger、Penicillium funiculosumに対してMICが1ppm(パーツパーミリオン)および0.5ppm(パーツパーミリオン)の非常に強い効果を有する。しかし、これらイソチアゾリン系薬剤は高い皮膚刺激性や眼刺激性を有することより取り扱いに注意を要する。
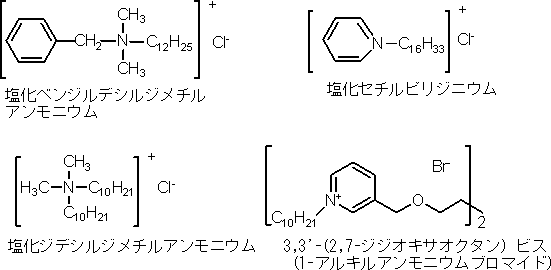
<第四アンモニウム塩系>第四アンモニウム塩は1935年にGerhard J. Domagkにより、その殺菌活性が見いだされて以来、多種の化合物が開発され、消毒剤として利用され効果を上げてきた。その主なものはモノ型の塩化ベンザルコニウム(病院での消毒剤)、塩化セチルピリジニウム(デンタルリンスや練り歯磨きの殺菌剤)、塩化ジデシルジメチルアンモニウム(食品製造環境殺菌剤)が使用されてきたが、最近我が国においてアンモニウム塩ヘッドを2個有する対称型のジェミニ型(双子型)のアンモニウム塩が開発された(図13)。前者のモノ型の第四アンモニウム塩は細菌に対して高い効果を示すが、細菌芽胞や真菌に対して殺菌効果が低く、低い温度環境や酸性環境に加えタンパク質の共存下では殺菌活性が低下する傾向があった。しかし、ジェミニ型のアンモニウム塩は、細菌、芽胞、真菌、カビ胞子に対しても非常に強い殺菌効果を示し、細菌の表層構造破壊や湿潤環境や水環境でのバイオフィルムの発生を抑える効果が見いだされた。また、ジェミニ型殺菌剤は、薬剤耐性菌の出現を極めて低く抑えることができるなど優れた特徴を有している。さらに、細胞壁の厚いアルコール酵母(Saccharomyces cerevisiae)の栄養細胞、黒麹カビ(Aspergillus niger)の胞子に対して30分の接触で5〜20ppm(パーツパーミリオン)程度の低濃度において高い殺胞子活性が認められた。本薬剤は毒性(血液毒性、経口毒性)が低く、皮膚感作性が陰性であり、少し弱い皮膚刺激性を示すものの資料の展示室や保存施設におけるカビ胞子数を低減させる環境消毒剤として効果を発揮すると思われる。なお、防カビ剤の詳細については「防菌・防黴剤の開発と展望」、シーエムシー出版および「菌防黴剤原体事典」、日本防菌防黴学会を参照。
4.カビ被害防止のための管理について 文化財は人間の歴史と関係する遺物・遺産であって、その歴史伝承の媒体として後世に伝えることを目指している。そのため文化財保存の最終目的は、実物(オリジナル)の保存であり、具体的には形態の保存と価値(鑑賞における色、使用痕、環境履歴)の保存が求められる。 表5 IPMに則ったカビ被害対策の進め方
カビ被害対策の段階的実行 資料への微生物被害を抑えるにあたって、資料特有の制限がある。例えば、資料表面に滅菌や防カビのために薬剤を塗布することは、将来の変色などを誘発するおそれもある。また栄養物等の除去のための表面クリーニングは、資料の破損を招く怖れもあり頻繁には行えない。そのため、すでに広範にカビ被害を受けてしまった資料については、ガス燻蒸で殺菌し、再発しないように環境整備を計画することが必要となる。資料への微生物被害対策としてなによりも重要なことは、微生物が繁殖しにくい環境に資料を保管することしかない。博物館等で保管されている資料は保存環境を管理して、資料周辺を清浄に保ち、高湿度環境にならないように計測監視することが重要である。 <回避> カビ被害を回避するには、何よりも生えにくい環境を整えることにある。資料表面のクリーニングは専門の技術者であっても難しく、また人間が利用できる空間として酸素濃度は下げられないため、カビ発生抑止のために採用できる方法は、カビが利用できる水分量を低減して、温度設定を見直し、発生速度を遅くすることである。また同時に、大気からの塵埃により資料表面に栄養物が蓄積され、また外気から胞子に汚染された空気が流入する場合もあるため、空気清浄化を計画することが重要である。 <遮断> 遮断の処置としては、汚染された資料の持ち込みを抑制し室内の微生物量を低減することのほか、資料とその周囲のクリーニング、汚染拡大防止のための措置などがある。微生物はたいそう小さく、空気と同じ挙動をするため、空気の流れのとおりに拡散していく。室内空気を清浄化するよう計画し、空調機にHEPAフィルターを組み込む、空気清浄機を増設するなど、遮断には機器類のサポートも必要である。 <監視> 監視には、資料そのものを点検して微生物被害発生の早期発見・対処を目的とする活動と、環境を監視して微生物被害発生を遅らせる活動がある。 <対応> 緊急処置として、カビ被害の拡大を防ぐために、資料をすみやかに隔離する必要がある。カビが生えている区画への無駄な立ち入りの制限、閲覧等の利用を一時的に中止して、カビの生えている区画とその他の区画間の空気交換が行われにくい状況に管理する。 <保存体制の見直し> 資料保存管理のためには、管理者による継続した監視、記録と設備が必要である。設備については常に稼働状況を監視し、適宜更新が必要である。また、管理者が保存に取り組みやすい状況を全体で作り出すとともに、研修などを通して常に情報を集め、多様な対処法を身につけることができるようバックアップしていくことが必要なのである。 5.カビ被害の早期発見と緊急対策 カビ被害は発生のための環境・栄養条件が整い次第、やや広い範囲で同時に発生するため、できる限り被害の小さいうちに発見して、除菌・消毒による緊急対応とともに保存環境の見直しを進め、被害の拡大を抑えることが重要である。
であり、番号の小さな対策ほど有効性が高い。何ら情報を与えられていない、研修機会のない労働者の労働環境を守るためには、( |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Copyright (C) Ministry of Education, Culture, Sports, Science and Technology