- 現在位置
- トップ > 政策・審議会 > 審議会情報 > 科学技術・学術審議会 > 資料3‐2 地球上の生命を育む水のすばらしさの更なる認識と新たな発見を目指して > 第4章 水の特性を生かした様々な活用 3 溶媒としての水
第4章 水の特性を生かした様々な活用 3 溶媒としての水
3 溶媒としての水 東京大学大学院薬学系研究科教授 小林 修
(要旨)
有機化合物の化学反応を行う場合、一般に、化合物を溶解させるためにトルエンやクロロホルムといった有機溶媒が使われるが、有機溶媒の中には人体にとっても環境にとっても有害なものもあり、その使用をなるべく限定したい。そこで近年、有機溶媒に代わる「環境に優しい溶媒」が探索されてきた。その候補の中で最も魅力的なものが水である。水は、無毒・無害なだけではなく、通常用いられる有機溶媒に比べて極めて安価であるという利点もある。一方、多くの反応剤や触媒が水と反応して分解してしまう、また、反応させたい有機化合物の多くが水に溶けないという問題点がある。
そこで、ルイス酸(※1)を触媒として用いる有機合成の研究を進め、ルイス酸?界面活性剤一体型触媒(あるいは英訳の頭文字をとって「LASC(ラスクと発音)」)を開発した。このLASCは、今まで困難とされていた水中でのルイス酸触媒反応を効率的に行わせることができる。
また、反応液を遠心分離器にかけると、下部に有機化合物が凝集し、上部に水が分離し、両者の中間にLASCが析出する。ここから有機化合物だけを取り出すことは簡単にできるため、この遠心分離の方法によって、有機溶媒を一切使用しない反応工程の開発が原理的には可能となった。水のみを溶媒として用いる反応プロセスの実現に一歩近づいたと言えよう。
ただし、水中での有機合成反応は、その研究が端緒についたばかりであり、未知の部分が多く、今後改良すべき点も多い。例えば、これまでに開発されてきた有機溶媒中でのルイス酸触媒反応に比べて、水中での反応は、その反応の種類においても、使用できる反応基質の種類においても、まだ限りがある。
21世紀を目前にして環境調和型の「持続可能な発展」が叫ばれている現在、水中での合成反応がその重要性を増すことは確実であり、多くの方が今後この領域に興味を持って下さることを願ってやまない。
3 溶媒としての水
有機化合物の化学反応を行う場合、一般に、化合物を溶解させるためにトルエンやクロロホルムといった有機溶媒が使われる。このことは、いわば化学の「常識」になっているが、一方、有機溶媒の中には人体にとっても環境にとっても有害なものもあり、その使用をなるべく限定したい。そこで近年、有機溶媒に代わる「環境に優しい溶媒」が探索されてきた。その候補の中で最も魅力的なものが水である。水は、無毒・無害なだけではなく、通常用いられる有機溶媒に比べて極めて安価であるという利点もある。したがって、水を有機合成反応の溶媒として使うという一見「非常識」な方法が、化学研究の対象として注目されてきている。
ではなぜ、水中での有機合成反応は非常識なのか。それは、通常、水を溶媒として使う場合、大きな問題点が二つあるからである。第一の問題点は、多くの反応剤や触媒が水と反応して分解・失活してしまう、という点である。第二の問題点としては、反応させたい有機化合物の多くが水に溶けない、という点が挙げられる。これらの「分解の問題」と「溶解性の問題」を克服するために、私達を含めた世界中の化学者が研究を重ねてきた。ここでは、私達の研究成果を中心に水中での有機合成反応の現状と展望について述べてみたい。
3-1 水があっても分解しないルイス酸
私達のグループでは以前より、種々のルイス酸を触媒として用いる有機合成の研究を行ってきていた。ルイス酸は、有機合成において現在に至るまで幅広く用いられており、合成化学には無くてはならない活性化剤である。今から約10年前の時点では、「ルイス酸は水に対して不安定で簡単に分解してしまう」というのが化学の「常識」であった。したがって、ルイス酸を合成反応に使用するときは、反応溶媒や反応させようとする化合物(反応基質)から徹底的に水分を取り除き、更に、ルイス酸が空気に触れないようにして(空気中の湿気で分解してしまう!)実験しなければならなかった。
当時私達は、ルイス酸として金属トリフルオロメタンスルホナート(トリフラート)に注目していた(図1)。
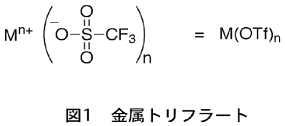
金属トリフラートは、強力な電子吸引基であるトリフルオロメタンスルホニル基を持っているため、強いルイス酸である。そこで、様々な金属トリフラートを合成しようとそれらの合成法を文献調査したところ、大変興味深い文献に出会った。それは、ランタノイド金属を含んだランタノイドトリフラートの合成法に関するものである。その文献によれば、ランタノイドトリフラートは、トリフルオロメタンスルホン酸の水溶液とランタノイド金属の酸化物を加熱して合成されていた(図2)。
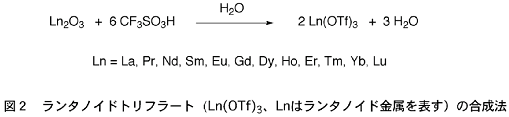
注目すべきは、ランタノイドトリフラートが水溶液中で合成されている点である。私達がそれまで合成していた金属トリフラートは、通常のルイス酸同様、徹底的に水を取り除いた条件で調製していたのに対し、ランタノイドトリフラートは水溶液中で合成できるというのだ。これは極めて魅力的に感じられた。なぜなら、ランタノイドトリフラートが通常のルイス酸とは異なり、水があっても分解しないルイス酸として使える可能性があると考えたからである。
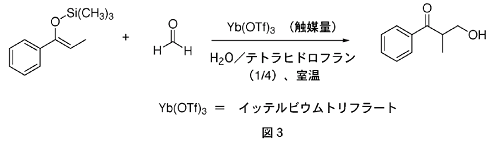
そこで実際に、水を含む溶媒中でランタノイドトリフラートを用いたところ、ルイス酸触媒として機能することが明らかになった。例えば、図3に示す反応は、水とテトラヒドロフランの混合溶媒中で、ランタノイドトリフラートの一つであるイッテルビウムトリフラートを少量添加することにより効率的に進行した。ここで使っている反応剤のホルムアルデヒド(H2C=O)は、通常は水溶液(ホルマリン溶液と呼ばれる)が最も入手容易な状態である。もしこの反応を水に対して不安定な従来のルイス酸を使って行おうとすると、水を含んでいないガス状のホルムアルデヒド(調製に手間がかかる)を用いなくてはならない。一方、イッテルビウムトリフラートは水中でも有効に機能するため、ホルマリン水溶液を直接使用できることになり、従来の方法にくらべて格段に操作が楽になった。
また、水が存在しても分解しないこれらのランタノイドトリフラートは、反応終了後に反応生成物と分離することで簡単に回収でき、次の反応に再使用できる。つまり、これらはリサイクル可能なルイス酸である。限りある地球資源を有効利用するために今、あらゆる分野でリサイクル化が進められているが、触媒化学の分野でもリサイクル化は重要な研究課題であり、その意味でも、ランタノイドトリフラートがリサイクル可能であるということは重要な意味を持っている。
この含水溶媒中でのルイス酸触媒反応の発見以来、様々な金属塩がランタノイドトリフラートと同様に、あるいはそれ以上に有効に、水存在下でもルイス酸として機能することがわかってきた。これに関しては、本稿の最後に少し解説する。また、これらのルイス酸が触媒できる反応の種類も増え、現在までのところ、アルドール反応、アリル化反応、Diels-Alder反応、Michael反応など、いろいろな種類の反応が含水溶媒中で行えるようになってきている。水に対して不安定な従来のルイス酸を水存在下で扱う場合、ルイス酸の分解に常に直面していた。しかし、上記のルイス酸の登場によって状況は大きく変わりつつある。つまり、水中での有機合成反応における第一の問題点「分解の問題」は、少なくともルイス酸触媒反応に関しては、解決の糸口が見つかったと言える。
3-2 界面活性剤を用いる触媒反応
ランタノイドトリフラートをはじめとする上記のルイス酸によって、含水溶媒中での触媒反応が効率良く行えることがわかった。次の問題は、前述した水中での有機合成反応における第二の問題点、「溶解性の問題」に関連するものである。上記の触媒反応では、溶媒として水と有機溶媒(例えばテトラヒドロフランやエタノールなど)との混合溶媒を使わねばならなかった。ここで有機溶媒を加えないと、基質である有機化合物が水にほとんど溶けず、その結果、触媒反応の進行が非常に遅くなってしまう。環境に優しい合成反応の実現のためには、ぜひとも有機溶媒を全く使用しない反応を開発する必要がある。そこで私達は、有機溶媒を全く使用せずに水だけを溶媒とするルイス酸触媒反応の開発に取りかかった。
一般に、油(有機化合物)と水とは混ざらない。ところが、油と水とを混ぜ合わせることを可能とする物質がある。それは、界面活性剤である。界面活性剤は、水と馴染みやすい親水性部分と有機物と馴染みやすい疎水性部分とから成っている。水中に油状の有機化合物を入れると混ざり合わずに二層に分離するが、そこにある種の界面活性剤を少量加えると、界面活性剤の疎水性部分が油と、親水性部分が水とそれぞれ作用し、水中にミクロレベルのコロイド粒子を形成する(図4)。その結果、水と油は見かけ上は、牛乳のように不透明ながらも混ざり合ったコロイド溶液になる。
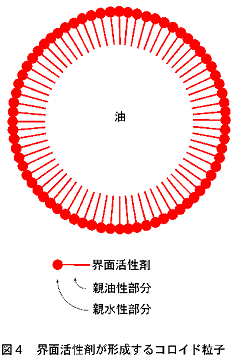
この界面活性剤の性質を利用すれば、水に溶けない有機化合物の「溶解性の問題」を解決でき、ルイス酸触媒反応を効果的に行わせることができるのではないだろうか。そう考えた私達は、界面活性剤と水存在下でも機能するルイス酸とを組み合わせて使うことを計画した。その概念図を図5に示す。通常の有機化合物は水に溶けずに、相分離した状態で存在する(図5、左)。そこに、界面活性剤と触媒分子とが組み合わさった「界面活性剤型触媒」を加えると、有機化合物が水中に分散したコロイド溶液となり(図5、右)、反応基質と触媒分子との接触が効率的に起こり、触媒反応が速やかに進行する。このような期待のもと、界面活性剤型触媒の開発に取りかかった。
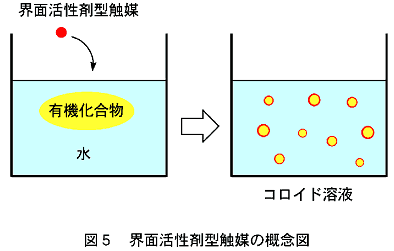
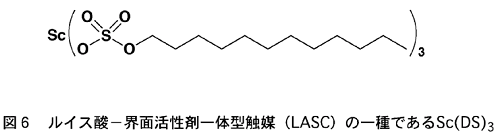
そして実際に、含水溶媒中で有効なルイス酸であるスカンジウム(Sc)陽イオンと、代表的な界面活性剤であるドデシル硫酸陰イオンとを一体化させた触媒分子を調製することができた(図6)。このような触媒を私達は、ルイス酸?界面活性剤一体型触媒(あるいは英訳の頭文字をとって「LASC(ラスクと発音)」)と呼んでいる。
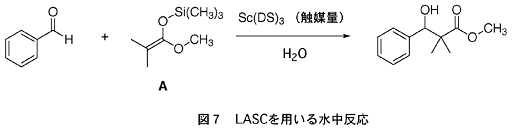
このLASCの一種であるSc(DS)3を使って、図7に示した反応を水だけを溶媒として行ったところ、ルイス酸触媒反応が速やかに進行し、LASCが水中で有効に働くことが明らかになった。また、ここで用いた反応基質Aは、水と反応して分解しやすい不安定な化合物である。このような基質を用いても水中で望むルイス酸触媒反応が円滑に進行するというこの実験結果は、私達にとって驚きであった。
また、LASCは、水中でのみ有効に機能することも判明した。LASCによる触媒反応を、代表的な有機溶媒である塩化メチレンを溶媒として用い行ってみると、水中での反応は塩化メチレン中での反応と比べて100倍以上速く進行することがわかった。このような、水中でのみ有効に機能するLASCの性質は、後に述べる反応場形成と大きく関わっていると考えられる。
更にその後、LASCは様々な種類の水中反応に使用できることがわかり、ルイス酸と界面活性剤とを一体化させるという手法が、水中での反応に極めて有効であることが実証された。
3-3 LASCが形成する反応場
反応基質Aのような加水分解されやすい基質が水中でも分解せずに存在することから、水が排除されているような疎水的な領域(疎水的反応場)が水中に形成されている可能性が考えられる。そこで次に私達は、LASCがどのような反応場を水中に形作っているのかを調べてみた。
図8に、実際の反応液の様子を示した。左側の試験管は、水にLASCを加えたものである。LASC自体は水に溶けずに沈澱している。そこに反応基質を加えたものが右の試験管である。液が牛乳のように一様に濁り、コロイド溶液になっている。つまりLASCは、基質分子と相互作用しあって初めてコロイド溶液を形成することができるようになる。

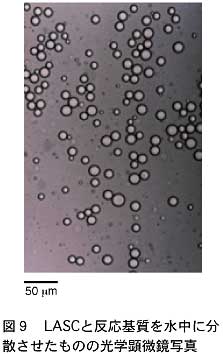
このコロイド溶液を更にミクロレベルで観察するため、光学顕微鏡で溶液を見てみることにした。その様子を図9に示す。球状の微少粒子が水中に分散していることがわかる。更に種々の分析手段により、この微少粒子の平均直径が約1マイクロメートルであることが判明し、また粒子の中身は水ではなく反応基質であることが示唆された。したがって、この粒子こそが、LASCによって水中に形成された疎水的反応場であると、私達は考えている。この反応場の中に存在する基質分子は、水から効果的に遮断され、自身の加水分解を最小限に抑えながら、望むルイス酸触媒反応を起こすものと考えられる。このようにLASCは、ルイス酸として機能するだけではなく、反応場形成にも役立っていることが明らかになった。
3-4 水中で安定なルイス酸
多くのルイス酸が水中で速やかに加水分解されるのに対して、希土類金属トリフラートはなぜ水中で安定でルイス酸として機能できるのだろうか。この問いに対しては、中心元素の比較的大きなイオン半径およびルイス酸と水との間の平衡関係から説明がなされてきたが、ごく最近私達は、イオンの加水分解定数と内圏水配位子の置換に対する交換速度定数に関連付けてより明確な説明を行うと同時に、実験的な検証も得ることができた。すなわち、加水分解定数が4.3から10.08の範囲にあり、かつ水配位子の交換速度定数が3.2×106M-1s-1以上の値を持つイオンとして、希土類の他に鉄(Ⅱ)、銅(Ⅱ)、亜鉛(Ⅱ)、カドミウム(Ⅱ)、鉛(Ⅱ)が相当し、実際これらを中心元素とする塩が例外なく水中でルイス酸として機能することを実験的に示すことができた。加水分解定数はルイス酸性と相関があると考えられ、また、水配位子の交換速度定数が大きいということは中心元素に配位した水が頻繁に元素から離れることになり、これはすなわちルイス酸点が空くことを意味する。上述した加水分解定数および水配位子の交換速度定数の数字の範囲の絶対的な意味は明らかではないが、この範囲には入らないが近い数字を示すマンガン(Ⅱ)および銀(Ⅰ)も水溶液中である程度ルイス酸として機能することを実験的に明らかにしている。新たな触媒の予見と反応機構的考察から、水中でのルイス酸の化学は新たなステージを迎えたと言える。
3-5 有機溶媒を全く使用しない反応プロセスに向けて
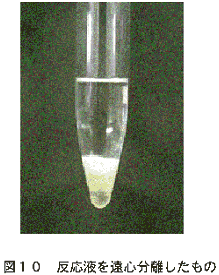
LASCは、今まで困難とされていた水中でのルイス酸触媒反応を、効率的に行わせることができる。ただしこれまで述べた例では、反応液から生成物を取り出すために、反応終了後に有機溶媒を加え、生成した有機化合物を抽出していた。この有機溶媒による抽出過程を経ずに有機化合物を取り出すことができれば、反応工程の開始から終了までの間、有機溶媒を一切使用しないプロセスが実現できる可能性がある。そこで、有機溶媒を使用せずに反応生成物を取り出す方法を探索したところ、遠心分離の手法が有効であることがわかってきた。反応液は白く濁ってコロイド溶液になっているが、これを遠心分離器にかけると、下部に有機化合物が凝集し、上部に水が分離し、両者の中間にLASCが析出する(図10)。ここから有機化合物だけを取り出すことは簡単にできるため、この遠心分離の方法によって、有機溶媒を一切使用しない反応工程の開発が原理的には可能となった。水のみを溶媒として用いる反応プロセスの実現に一歩近づいたと言えよう。
強酸ではなくルイス酸を水中で触媒的に用いる炭素ー炭素結合生成反応は、有機合成の中核を成し、時代の要求でもあるクリーンな化学として広く受け入れられるものである。今後この分野の研究はますます重要になっていくであろう。有機溶媒を全く用いず水中で反応を行い、またルイス触媒を100パーセント回収、再使用できるシステムが工業化される日も遠くない。一方、単に有機溶媒から水溶媒へのスイッチではなく、水溶媒の特性を活用した反応開発も重要である。水中でのルイス酸触媒作用の反応機構的議論は、まさに元素の本質に迫るものであると同時に、新たに浮上してきた元素のいくつかは生体内反応においても重要な触媒作用をしている点は実に興味深い。
一方、水中での有機合成反応は、その研究が端緒についたばかりであり、まだ未知の部分が多く、解決すべき問題点も山積みされている。私達の開発したLASCは、この分野に一つの指針を与えるものだと自負しているが、今後改良すべき点も多い。例えば、これまでに開発されてきた有機溶媒中でのルイス酸触媒反応に比べて、水中での反応は、その反応の種類においても、使用できる反応基質の種類においても、まだ限りがある。水中での触媒的不斉合成反応への展開も、極めて重要かつチャレンジングな課題であろう。21世紀を目前にして環境調和型の「持続可能な発展」が叫ばれている現在、水中での合成反応がその重要性を増すことは確実であり、多くの方が今後この領域に興味を持って下さることを願ってやまない。
(参考文献)
S. Kobayashi, Synlett, 1994, 689-701.
S. Kobayashi, Eur. J. Org. Chem., 1999, 15-27.
S. Kobayashi, K. Manabe, Pure Appl. Chem., 72, 1373-1380 (2000).
S. Kobayashi, K. Manabe, Acc. Chem. Res., 35, 209-217 (2002).
S. Kobayashi, M. Sugiura, H. Kitagawa, W. W.-L. Lam, Chem.Rev, 102, 2227-2302 (2002).
※1ルイス酸とは、1923年にアメリカの物理化学者G. N. ルイスが電子の授受に基づいて定義した酸。電子対を与えて相手と共有結合を形成するものを塩基、電子対を受け取る相手を酸とする。(広辞苑より)
お問合せ先
科学技術・学術政策局政策課
-- 登録:平成21年以前 --