|
3 薬事行政に係る権利制限について
 |
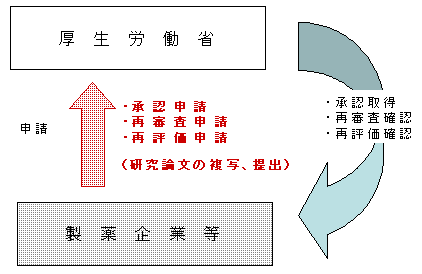
承認・再審査・再評価制度において,申請書に研究論文等を添付する必要があるため,研究論文等の複写を作成し,国等に提出することについて |
 |
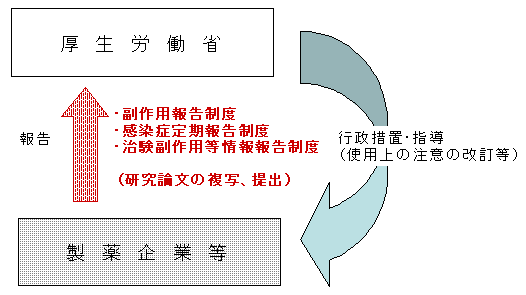
副作用・感染症報告制度・治験副作用報告制度において,期間内に副作用等の発現に係る研究論文等の複写を作成,調査し,国等に提出することについて |
 |
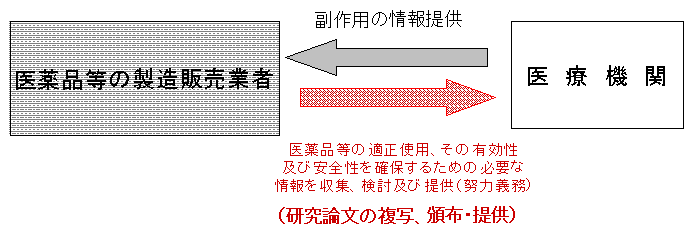
医薬品等の製造販売業者は医薬品等の適正使用に必要な情報を提供するために,関連する研究論文等を複写し,調査し,医療関係者へ頒布・提供することについて |
|
ア 問題の所在
著作物は,裁判手続のために必要と認められる場合には,その必要と認められる限度において,複製することができる(第42条)。ここにいう「裁判手続」には「行政庁の行う審判その他裁判に準ずる手続を含む」とされ(第40条第1項),このような準司法手続としては,例えば,特許審判,海難審判あるいは行政不服審査が含まれる。一方,「立法又は行政の目的」のために必要な場合については,「内部資料として必要」と認められる限度においてのみ複製が許容されている(第42条)。
一方,薬事法では,医薬品の使用によってもたらされる国民の生命,健康への被害を未然に防止するため,医薬品の品質,有効性及び安全性を確保するために必要な各種関連情報の収集,評価,報告,保存を製薬企業等に義務付けている。具体的には,薬事法上の手続として, 製造販売を行う医薬品の承認・再審査・再評価手続における申請書への研究論文等の添付(薬事法第14条,第14条の4,第14条の6), 製造販売を行う医薬品の承認・再審査・再評価手続における申請書への研究論文等の添付(薬事法第14条,第14条の4,第14条の6), 副作用・感染症の報告に係る制度(薬事法第77条の4の2)や治験に関する副作用等の報告制度(薬事法第80条の2第6項)がある。また, 副作用・感染症の報告に係る制度(薬事法第77条の4の2)や治験に関する副作用等の報告制度(薬事法第80条の2第6項)がある。また, 医薬品等の製造販売業者には,医薬品等の適正使用に必要な情報の収集,検討及び医療関係者への提供について,努力義務が課せられている(薬事法第77条の3)。 医薬品等の製造販売業者には,医薬品等の適正使用に必要な情報の収集,検討及び医療関係者への提供について,努力義務が課せられている(薬事法第77条の3)。
これらの手続は,第42条における「裁判に準ずる手続」とは言えず,その過程で必要とされる文献を権利者の許諾なく複製することはできない。しかし,医薬品の効果や,副作用等の評価を適時・適切に実施するためには,製薬企業における副作用,感染症等の情報収集・分析・報告等が十分に,しかも迅速に行われることが必要であり,その際には,関連する研究論文等の複写の作成・頒布が必要となる場合が多い。このため,薬事法上の各種手続について,第42条に定める権利制限を認めてほしいとの要望がある。
【薬事法上の各種手続の概要】(出典:厚生労働省)
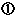 承認・再審査・再評価制度の概要 承認・再審査・再評価制度の概要
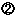 副作用・感染症報告・治験副作用報告制度の概要 副作用・感染症報告・治験副作用報告制度の概要
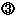 医薬品等の製造販売業者による研究論文等の配付 医薬品等の製造販売業者による研究論文等の配付
【諸外国の状況】(出典:厚生労働省,日本製薬団体連合会)
 |
承認・再審査・再評価制度において,申請書に研究論文等を添付する必要があるため,研究論文等の複写を作成し,国等に提出することについて |
 |
副作用・感染症報告制度・治験副作用報告制度において,期間内に副作用等の発現に係る研究論文等の複写を作成,調査し,国等に提出することについて |
| 欧米いずれの国においても,重篤な副作用に関する症例情報等について,行政官庁への提出の義務を課している。このように国が提出を義務付けている資料に関しては,ドイツでは,著作権の権利制限の範疇としてとらえている。米国では「fair use」の範疇でとらえられるかどうかは裁判で争うことができるが,法や規則によって強制的にコピーを提供することを義務付けている場合,著作権の侵害とならないとした判例(SmithKline Beecham v. Watson Pharmaceuticals, 211 F.3d 21 (2nd Cir.2000))(注)がある。 |
(注) FDA(米国・食品医薬品局)への一般医薬品の承認申請の際に,同一の先行医薬品でFDAの承認を受けているラベル(当該医薬品に附属するパンフレット等も含む)と同一のラベルを,FDAに提出することが義務付けられている事案
| 例: |
ドイツ著作権法 |
|
| |
・45条 |
制限規定 |
| |
1項 |
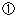 裁判所,仲裁,公共機関における手続に使用される目的での文献のコピーは権利の例外となる。 裁判所,仲裁,公共機関における手続に使用される目的での文献のコピーは権利の例外となる。 |
| |
|
⇒製造承認取得の目的で作成される書類(文献コピーの添付を含む。)は権利制限に含まれる。 |
| |
|
⇒更に,上記手続に使用するために必要な書類を前もって準備し,保管することも許可される。 |
| |
3項 |
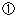 上記 上記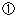 の目的で使用するために提供することも許可される。 の目的で使用するために提供することも許可される。 |
| |
|
⇒製造承認取得の目的で厚生省に提出することも許可される。 |
| |
|
 更に,上記 更に,上記 の申請時点で,医師等の意見を求める場合には,当該医師等への提供も許可される。 の申請時点で,医師等の意見を求める場合には,当該医師等への提供も許可される。 |
 医薬品の製造販売業者は医薬品等の適正使用に必要な情報を提供するために,関連する研究論文等を複写し,調査し,医療関係者へ頒布・提供することについて 医薬品の製造販売業者は医薬品等の適正使用に必要な情報を提供するために,関連する研究論文等を複写し,調査し,医療関係者へ頒布・提供することについて
| どの国も医療機関への文献提供を明確に義務付けていない。 |
イ 検討結果
要望 と と については,国等への迅速な情報伝達により国民の生命,健康への被害を未然に防止するという観点から,現に支障が生じているものについては,権利制限を行うことが必要とする意見が多かった。 については,国等への迅速な情報伝達により国民の生命,健康への被害を未然に防止するという観点から,現に支障が生じているものについては,権利制限を行うことが必要とする意見が多かった。
現行法でも,第42条は,内部資料として必要な限度で行政目的の複製を認めていることから,厚生労働省等が内部資料として,様々な文献の複写を権利者の許諾なく行うことは可能であることから,このような制限規定を置いたとしても,権利者にとっても結果的に被る制約は現状と同程度であると考えられる。したがって,権利制限を認めても,著作物の通常の利用を妨げず,かつ,著作者の正当な利益を不当に害することにはならないと考えられる。
要望 については,国民の生命・健康を守るために,薬事法に規定された努力義務を果たすために行われる医療関係者への情報提供であり,複製した者が複製物から直接的な利益を得るものではないことから,権利制限の対象とすることに賛成する意見があった。また,権利制限を認めない場合には,権利者の許諾を得るのに時間がかかりすぎるのではないか,権利者が探索できない場合は利用ができず,結果的に患者にしわ寄せがいくのではないかとの意見もあった。医薬品等の製造販売業者による情報提供が果たしている社会的役割にかんがみ,権利者側においては,利用者側の利便への一層の配慮が求められる。 については,国民の生命・健康を守るために,薬事法に規定された努力義務を果たすために行われる医療関係者への情報提供であり,複製した者が複製物から直接的な利益を得るものではないことから,権利制限の対象とすることに賛成する意見があった。また,権利制限を認めない場合には,権利者の許諾を得るのに時間がかかりすぎるのではないか,権利者が探索できない場合は利用ができず,結果的に患者にしわ寄せがいくのではないかとの意見もあった。医薬品等の製造販売業者による情報提供が果たしている社会的役割にかんがみ,権利者側においては,利用者側の利便への一層の配慮が求められる。
ただし,利用する際には,権利者の許諾が必要であるという原則にたてば,情報提供のために関連する研究論文等を複製することは,医薬品等の製造業者の自己責任で実施すべきであり,権利制限については,複製主体も頒布先も特定されておらず,学術論文全部分の複製になることも予想され,かつ複数文献の数も多数になる可能性があることから,慎重な検討が必要ではないかとする意見があった。また,仮に権利制限するとした場合でも,複製文献の数が多いために権利者への影響が大きく,無償とすることは困難ではないかなどの意見があった。
現在,権利者側は,著作物の複製利用促進の観点から,日本複写権センター,学術著作権協会並びに日本著作出版権管理システム等の管理団体に対して複写に係る権利の委託を行い,利用者に許諾を与えると同時に利用料を徴収し,権利者へ分配するという,権利委託と許諾システムに積極的に取り組んでいる。したがって,当面は,関係者の最大限の努力の下,構築されているシステムが利用料の徴収の観点から有効に機能し著作権処理の適正化が行われていくか注視することとするが,医薬品等の適正使用に必要な情報提供の複写の実態を十分踏まえた上で,著作権者等への影響を勘案して,適切な措置について引き続き検討を行うことが適当である。
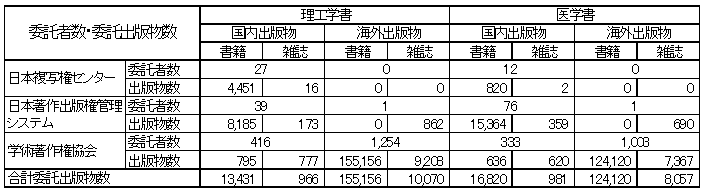
【参考:理工学書(特許審査関連),医学書(薬事行政関連)出版物委託状況】
(出典:社団法人日本書籍出版協会等調べ)
【参考:薬事法上各種手続申請・報告件数】
(出典:厚生労働省調べ)
・平成16年度承認申請件数:約1,900件
・平成16年度再審査申請件数:66件
・平成16年度再評価申請件数:約1,060件(ただし,文献を添付したものはない)
・平成16年度副作用・感染症報告:約25,000件
・平成16年度治験時副作用等報告:約37,000件
・平成16年度感染症定期報告:約1,100件 |
|
|